Mối quan hệ giữa tính ổn định của IAA và IBA trong nhiều quy trình nuôi cấy mô đã được đánh giá. IBA ổn định đáng kể so với IAA khi hấp khử trùng. IBA cũng cho thấy tính ổn định nhiều hơn IAA trong môi trường Murashige và Skoog lỏng trong các điều kiện của tủ tăng trưởng.
Tóm tắt
Mối quan hệ giữa tính ổn định của
IAA và
IBA trong nhiều quy trình nuôi cấy mô đã được đánh giá. IBA ổn định đáng kể so với IAA khi hấp khử trùng. IBA cũng cho thấy tính ổn định nhiều hơn IAA trong môi trường Murashige và Skoog lỏng trong các điều kiện của tủ tăng trưởng. Tính ổn định của IBA và IAA cũng tương tự trong môi trường MS rắn. Ánh sáng được cung ấp bằng ống đèn huỳnh quang thúc đẩy sự phân hủy IAA và IBA trong cả môi trường lỏng và rắn. Than hoạt tính ở các nồng độ cao như 5% cho thấy hấp thụ hơn 97% IAA và IBA trong môi trường MS lỏng. Các kết quả này có tác động quan trọng đối trong quy trình chuẩn bị, bảo quản và sử dụng IBA và IAA trong nuôi cấy mô thực vật. Tên các hóa chất sử dụng: indole-3-acetic acid (IAA); indole-3-butyric acid (IBA).
Từ chỉ mục: biotechnology, plant growth regulators
Các auxin tự nhiên và nhân tạo được sử dụng rộng rãi trong nuôi cấy tế bào, mô và cơ quan để tìm ra các phản ứng hình thái học đặc biệt (Bhojwani và Razdan, 1983). Điều này được biết đến, tuy nhiên, các kết quả sử dụng các quy trình, loại và nồng độ auxin tương tự có thể khác nhau đáng kể trong phòng thí nghiệm, cản trở sự phát triển trên các quy trình chuẩn trong lĩnh vực như vi nhân giống. Cụ thể, các quy trình đa dạng đối với sự thay đổi các chất điều hòa tăng trưởng tiềm năng. Mặc dù các thành phần này được sử dụng rộng rãi, thông tin có hạn về tính ổn định của chúng dưới các điều kiện nuôi cấy mô.
IAA vẫn được dùng trong các nuôi cấy mô thực vật (Dai và cs, 1987; Grout và Read, 1986; Srivastava và cs, 1985) mặc dù có bằng chứng về tính không ổn định. Việc sử dụng các auxin, như IBA, naphthaleneacetic acid (NAA), và 2,4-dichlorophenoxyacetic acid (2,4-D), vẫn gia tăng vì chúng thường cho thấy nhiều hiệu quả hơn IAA trong cảm ứng các phản ứng hình thái học. Các auxin khác tăng cường hiệu quả hơn IAA được cho là nhờ tính ổn định của chúng. IBA được dùng nhiều hơn trong cảm ứng hình thành rễ bất định trong sự tăng tăng trưởng in vitro của táo và các loài cây thân gỗ khác, vì nó hiệu quả hơn IAA (James, 1983). Dunlap và cs (1986) gần đây được chứng minh rằng 2,4-D và NAA có tính ổn định trong thời gian dài hơn IAA trong môi trường MS lỏng. Phenylacetic acid (PAA) cũng cho thấy có tính ổn định tương tự trong quá trình nuôi cấy in vitro (Leuba và cs, 1989).
Nghiên cứu này được tiến hành để đánh giá hiệu quả tương đối của IBA, khi so với IAA, có phải là do tăng tính ổn định dưới các điều kiện in vitro. Hai auxin này được so sánh mối liên hệ tính ổn định từ hấp khử trùng đến các điều kiện trong tủ tăng trưởng khi kết hợp trong môi trường có và không có than hoạt tính.
Các nồng độ IAA và IBA được đánh giá bằng pha đảo ngược HPLC kết hợp với phát hiện huỳnh quang. HPLC là LDC Gradient Master với hai bơm Constametric II cung cấp các điều kiện rửa giải đẳng dòng của 60% nước (EM Science, Gibbstown, N.J.) chứa 0.1% HPLC-grade acetic acid (J.T. Baker, Phillipsburg, N.J.) và 40% acetonitrile (American Burdick và Jackson, Muskegon, Mich.). Đầu dò huỳnh quang 980 của Applied Biosystems (Foster City, Calif.) được cài bước sóng kích thích 220nm, và ánh sáng phát ra được theo dõi sử dụng bộ lọc băng thông 350 nm. IAA và IBA có thể tích duy trì tương ứng 3.2-6 ml, ở tốc độ dòng chảy dung môi rửa giải 1.5 ml/phút. Nồng độ auxin thấp ở 1ng/20 µl có thể đo cho kết quả đáng tin cậy; vì vậy, chúng tôi có thể dễ dàng đo mức giảm đến 97% so với nồng độ gốc 10 µM trong môi trường. Tiêm trực tiếp 20 µl dung dịch IAA và IBA 10 µM chứa tương ứng 34.4 ± 1.5 và 39.0 ± 1.0 ng IAA và IBA.
Môi trường nuôi cấy lỏng được tiêm trực tiếp vào HPLC. Các auxin được trích từ môi trường rắn sử dụng anhydrous ether. Trước khi trích ra, 10,000 dpm của IAA đánh dấu 14C hay 30,000 dpm của IBA đánh dấu 3H được thêm vào các mẫu 1ml agar. Agar được dập với 2ml 100mM đệm K₂HPO₄ chỉnh với pH 2.7 với H₃PO₄. Anhydrous ether (2 ml) được thêm vào, và các ống nghiệm được vortex trong 2 phút và ly tâm (2000xg) để lắng cặn agar. Dùng ống tiêm để chuyển 1ml của ether bên trên vào các ống vi tinh thể 1.5 ml. Ether được bốc hơi đến khi khô nhờ N2 và các mẫu được huyền phù trong 100 µl của methanol. Phần trăm thu hồi được đánh giá bằng các phần IAA và IBA thu lại và xác định phần phóng xạ sử dụng Packard (Grove, 111.) TRI-CARB 2200CA.
Các phần được nghiên cứu về ảnh hưởng của chúng lên sự ổn định IAA và IBA: 1) ảnh hưởng của hấp khử trùng và lọc vô trùng cho auxin, 2) pH của môi trường trước khi nuôi cấy, 3) khoảng thời gian chu kỳ hấp, 4) môi trường để trong điều kiện sáng/tối trong phòng tăng trưởng, 5) môi trường rắn và lỏng, và 6) bổ sung than hoạt tính đến môi trường nuôi cấy. Môi trường chuẩn (MS) sử dụng là các muối cơ bản môi trường Murashige và Skoog (1962), vitamin và sucrose. Mỗi môi trường được chuẩn bị, dung dịch stock auxin mới được pha ở nồng độ 10-mM trong ethanaol 95%. Các điều kiện hấp khử trùng chuẩn là 20 phút ở 121°C. IAA hay IBA (Sigma, St. Louis) được thêm vào ở 10 µM ở tất cả các nghiệm thức, ngoại trừ nêu ra trong các nghiên cứu với than hoạt tính. Mỗi nghiệm thức kết hợp mô tả phía dưới được chuẩn bị 3 lần và mỗi thí nghiệm được tiến hành hai lần. Dữ liệu được phân tích bằng kiểm tra đa giai đoạn Student Newman-Keuls (Miller, 1981).
Ảnh hưởng của hấp khử trùng và pH được nghiên cứu đồng thời. Môi trường MS chứa IAA hay IBA được chỉnh về pH 5.0 hay 5.7 với KOH trước khi hấp khử trùng; mỗi thiết lập của môi trường sau đó được hấp khử trùng trong 20-60 phút. Thiết lập tương tự của các nghiệm thức ở 5.0 và 5.7 được chuẩn bị, ngoại trừ IAA và IBA được thêm vào bằng lọc khử trùng thông qua lọc khử trùng Acrodisc 22-µ (Gelman, Ann Arbor, Mich.) sau khi hấp khử trùng môi trường được làm lạnh đến 60°C. Tất cả môi trường được xử lý như 250 ml dịch lỏng trong bình đựng Erlenmeyer 500 ml có nắp đậy. Ảnh hưởng của ánh sáng sự ổn định của IAA và IBA được đánh giá cả trong môi trường MS lỏng và rắn. MS lỏng được chuẩn bị 250 ml dịch lỏng được mô tả phía trên. Difco bacto agar, ở 0.8% (w/v), được thêm vào 250 ml MS lỏng trước khi hấp khử trùng. Tất cả môi trường được chỉnh về pH 5.7 trước khi hấp khử trùng. IAA hay IBA được bổ sung bằng lọc vô trùng vào môi trường hấp khử trùng được làm nguội đến 60°C. Môi trường lỏng vô trùng sau đó được phân phối 1ml vào các ống nuôi cấy thủy tinh có nắp đậy (tổng dung tích 25ml). Môi trường agar được phân phối 10ml vào các đĩa petri 60×15 mm. Một nửa ống nghiệm và đĩa petri được gói trong giấy bạc để ngăn ánh sáng. Ống nghiệm và đĩa petri được để trong tủ tăng trưởng Percival (Boone, Iowa) không lắc ở 24±2°C, trong chu kỳ sáng 16h và cướng độ ánh sáng dòng photon 74 µmol.sˉ¹.mˉ² được cung cấp bởi các ống đèn huỳnh quang. Ba ống nghiệm và 3 đĩa petri được chọn ngẫu nhiên ở mỗi nghiệm thức ở mỗi 2, 10, 20 và 30 ngày và môi trường được phân tích IAA và IBA được mô tả phía trên.
Ảnh hưởng của than hoạt tính (activated charcoal - AC) (Mallinckrodt, St. Louis) được kiểm tra trong MS lỏng. Các thí nghiệm được chỉnh ở kiểm tra cả các ảnh hưởng khi thêm các nồng độ khác nhau của AC đến nồng độ auxin ổn định và ảnh hưởng của sự bổ sung nồng độ riêng lẻ của AC trong vùng các nồng độ auxin. AC ở 0.1%, 0.25%, 1.0% và 5.0% (w/v) được thêm vào 10ml MS lỏng chứa 10 µM IAA hay IBA. Các ống nghiệm nuôi cấy được votex trong 3 phút và tiếp theo để trong tối thêm 60 phút. Ly tâm (2000× g) được dùng để lắng phần than hoạt tính huyền phù. Khả năng hấp thụ của than hoạt tính được kiểm tra bằng việc thêm vào 25mg AC đến 10ml MS lỏng chứa 10, 50, 100, 500 hay 1000 µM IAA hay IBA. Ống nghiệm được vortex và than hoạt tính được lắng như mô tả ở trên.
Các nồng độ IAA và IBA trong MS lỏng hấp khử trùng được giảm tương ứng 40% và 20%, khi so với các đối chứng lọc khử trùng (Hình 1). IBA ổn định hơn so với IAA trong cả các điều kiện hấp khử trùng được kiểm tra. Thời gian hấp khử trùng và pH của môi trường không ảnh hưởng đến việc thất thoát IAA hay IBA. Các kết quả, cho thấy sự thất thoát đáng kể ở cả hai loại auxin sau khi hấp khử trùng trong 20 phút, khác với các báo cáo trước (Dunlap và Robacker, 1988; Pence và Caruso, 1984; Yamakawa và cs, 1979). Pence và Caruso (1984) dùng kiểm tra sinh học cảm ứng rễ hơn là phép đo trực tiếp của IAA, phương pháp có thể cho kết quả sai. Yamakawa và cs (1979) xác định mức IAA sử dụng phương pháp indole-a-pyrone, quy trình cho thấy sự chấp thuận có hạn vì các vấn đề với các thành phần kết hợp (Crozier và cs, 1980). Chúng tôi không thể giải thích sự khác nhau giữa các kết quả và các kết quả này của Dunlap và cs (1986), người đã tìm ra rằng IAA ổn định khi hấp khử trùng.
Dưới các điều kiện tủ tăng trưởng, sự hao hụt IAA và IBA trong cả MS lỏng (Hình 2A) và rắn (Hình 2B) rất đáng kể. Trong môi trường lỏng, IAA nhạy cảm hơn IBA dẫn đến suy thoái phi sinh học (Hình 2A). Trong điều kiện sáng, các nồng độ IAA và IBA giảm tương ứng hơn 97% và 60%, sau 20 ngày. Trong điều kiện tối, các nồng độ IAA và IBA giảm tương ứng 70% và 30%. Sự thất thoát IAA trong MS lỏng tương ứng các kết quả báo cáo trước đây (Dunlap và Robacker, 1988; Dunlap và cs, 1986; Yamakawa và cs, 1979). Dunlap và cs (1986) báo cáo rằng khi tăng nồng độ muối MS tương quan với sự gia tăng mức IAA bị thất thoát trong điều kiện tối. Nghiên cứu của chúng tôi cho thấy sự phân hủy IAA trong điều kiện sáng nhiều hơn trong điều kiện tối, bất kể có hay không có agar, xác thực các nghiên cứu công bố trước (Dunlap và cs, 1986).
Sự thất thoát IAA và IBA trong MS rắn (Hình 2B) khác nhau đáng kể trong MS lỏng. Trong điều kiện tối, trên MS rắn, các nồng độ IAA và IBA giảm tương ứng 45% và 38% sau 30 ngày. Chỉ sau 3 ngày, trong điều kiện sáng, nhưng sự thất thoát IAA và IBA tương ứng »95% và 80% (Hình 2B). Dunlap và Robacker (1988) đề nghị rằng các muối và các chất vi lượng trong MS lỏng tương tác để đẩy nhanh sự phân hủy IAA trong ánh sáng. Agar cũng chứa một ít muối, vi lượng và các thành phần không tinh khiết khác (Debergh, 1983) có thể tương tác với ánh sáng thúc đẩy sự phân hủy IAA và IBA nhanh hơn trong MS lỏng. Chúng tôi không thể đưa ra lời giải thích cho việc hao hụt »35% IBA trong điều kiện tối khi không được phân tích sâu hơn hợp chất IBA. Các nghiên cứu bổ sung nhằm phân tích sự phân hủy các sản phẩm IBA không cần thiết để giải thích tiến trình suy thoái xảy ra trong điều kiện tối.
Than hoạt tính được thêm vào môi trường MS lỏng ở các nồng độ trong khoảng 0.1% đến 5% (w/v), các nồng độ giảm IAA và IBA hơn 97%. Sự bổ sung 0.25% AC vào MS lỏng chứa 10-500 µM IAA hay IBA bị đều hao hụt ở cả hai auxin. Ở 1000 µM auxin, chỉ 44.7% IAA và 12.5% IBA vẫn còn trong dung dịch. Các nghiên cứu trước đó, sử dụng sinh trắc học để định lượng các nồng độ auxin, cho gợi ý rằng than hoạt tính hấp thụ các chất điều hòa tăng trưởng được bổ sung đến các hợp chất độc tính (Fridborg và Eriksson, 1975; Fridborg và cs, 1978). Theo kiến thức của chúng tôi, nghiên cứu của chúng tôi là đầu tiên để xác định trực tiếp các nồng độ auxin trong môi trường MS lỏng bổ sung AC.
Các kết quả của nghiên cứu này biểu thị rằng quy trình nuôi cấy mô có thể ảnh hưởng đáng kể đến tính ổn định và tính khả dụng của IAA và IBA. Nồng độ IAA và IBA suy giảm, riêng lẻ trong môi trường rắn trong ánh sáng có ý nghĩa quan trọng trong quá trình giữ môi trường. Rõ ràng rằng trong ít nhất 10 ngày lưu trữ, đa số auxin có thể bị suy giảm. Vì vậy, thời gian chuẩn bị môi trường trong có quan hệ trong nuôi cấy các mẫu mô là tiềm năng biến đổi giữa các phòng thí nghiệm.
Sử dụng các hợp chất auxin được đề nghị có thể thay thế cho IAA (Hangarter và cs, 1980). Sử dụng chúng khá hạn chế, tuy nhiên, khi ảnh hưởng của chúng thường không tương tự IAA. Ví dụ, IAA-alanine, hợp chất hiệu quả nhất kiểm tra bởi nhóm Hangarter đến sự tăng trưởng mô sẹo, rõ ràng ức chế sự tăng trưởng rễ và chồi trong đánh giá sự tương phản đến hiệu quả IAA (Hangarter và cs, 1980). Thêm vào đó, mặc dù các hợp chất tương tự IAA cho thấy ổn định hơn IAA trong các mô thực vật, không có nghiên cứu nào được thực hiện để xác định trực tiếp sự ổn định của chúng trong hấp khử trùng, pH, ánh sáng và bảo quản.
Nghiên cứu của chúng tôi không cố giải thích sự khác nhau về hiệu quả giữa IAA và IBA khi dùng trong in vitro. Nhìn chung tính ưu việt của IBA hơn IAA in vitro vì nó có tính ổn định cao hơn được thể hiện trong các kiểm tra của chúng tôi. Rõ ràng, IBA ổn định hơn IAA trong MS lỏng. Trong MS rắn sự ổn định IBA tương tự IAA, cho rằng các tác nhân khác có liên hệ sinh học với IBA có thể góp phần vào các hoạt tính cao hơn như báo cáo của IBA in vitro. Các yếu tố, như các hợp chất khác biệt IAA và IBA có thể góp phần vào mối quan hệ hiệu quả cao hơn của IBA hơn IAA (James, 1983). Điều này cũng quan trọng để ghi nhận rằng than hoạt tính làm giảm đáng kể hoạt tính của IAA và IBA ngoại sinh ở các nồng độ auxin đến 500 µM. Vì vậy, khi than hoạt tính dùng để hấp thụ các hợp chất độc hại được thêm trong môi trường nuôi cấy mô, các nồng độ IAA và IBA có thể tăng từ 10 đến 100 lần để đảm bảo hiệu lực của chúng.
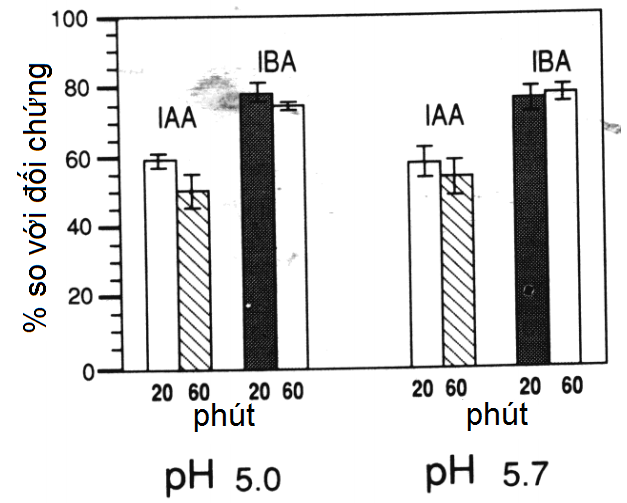
Hình 1. Ảnh hưởng của hấp khử trùng và pH lên tính ổn định của IAA và IBA trong môi trường MS lỏng. Các giá trị được thể hiện là phần trăm so với các nghiệm thức đối chứng lọc vô trùng. Thanh dọc biểu thị cho SE.
Hình 2. Sự ổn định của IAA và IBA dưới các điều kiện in vitro trong môi trường MS lỏng (A) và rắn (B). Phần hormone còn lại được biểu hiện là phần trăm của nổng độ ban đầu 10 µM. Thanh dọc là SE. Các ký hiệu không là thanh dọc có SE nhỏ hơn chiều cao của ký hiệu.
Tài liệu tham khảo:
Bhojwani, S.S. and M.K. Razdan. 1983. Plant tissue culture: Theory and practice. Elsevier, Amsterdam, The Netherlands.
Crozier, A., K. Loferski, J.B. Zaerr, and R.O. Morris. 1980. Analysis of picogram quantities of indole-3-acetic acid by high performance liquid chromatography fluorescence procedures. Planta 150:366-370.
Dai, C., V.N. Lambeth, R. Raben, and D. Mertz. 1987. Micropropagation of Rhododendron prinophyllum by ovary culture. HortScience 22:491-493.
Debergh, P.C. 1983. Effects of agar brand and concentration on the tissue culture medium. Physiol. Plant. 59:270-276.
Dunlap, J. and K. Robacker. 1988. Light and nutrient salts interact to destroy IAA in tissue culture media. Plant Physiol. 86:120.
Dunlap, J.R., S. Kresovich, and R.E. McGee. 1986. The effect of salt concentration on auxin stability in culture media. Plant Physiol. 81:934-936.
Fridborg, G. and T. Eriksson. 1975. Effects of activated charcoal on growth and morphogenesis in cell cultures. Physiol. Plant. 34:306-308.
Fridborg, G., M. Pederson, L. Landstrom, and T. Eriksson. 1978. The effect of activated charcoal on tissue cultures: Adsorption of metabolites inhibiting morphogenesis. Physiol. Plant. 43:104-106.
Grout, J.M. and P.E. Read. 1986. Influence of stock plant propagation method on tissue culture and leaf-bud propagation of ‘Northblue’ blueberry. J. Amer. Soc. Hort. Sci. 11:368-371.
Hangarter, R.P., M.D. Peterson, and N.E. Good.1980. Biological activities of indoleacetylamino acids and their use as auxins in tissue culture. Plant Physiol. 65:761-767.
James, D. 1983. Adventitious root formation in vitro in apple rootstocks (Malus pumila). I. Factors affecting the length of the auxin-sensitive phase in M.9 and M.26. Physiol. Plant. 57:154-158.
Leuba, V., D. LeTourneau, and D. Oliver. 1989. Stability of phenpacetic acid in liquid media. J. Plant Growth Regulat. 8:163-165.
Miller, R.G., Jr. 1981. Simultaneous statist&alinference. Springer-Verlag, New York.
Murashige, T. and F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15:473-497.
Pence, J.D.C. and J.L. Caruso. 1984. Effects of IAA and four IAA conjugates on morphogenesis and callus growth from tomato leaf discs. Plant Cell, Tissue & Organ Cult. 3:101-110.
Srivastava, P.S., A. Steinhauer, and H. Glock. 1985. Plantlet differentiation in leaf and root cultures of birch (Betula pendula Roth.). Plant Sci. 42:209-214.
Yamakawa, T., O. Kurahashi, K. Ishida, K. Shi geaki, T. Kodama, and Y. Minoda. 1979. Sta bility of indole-3-acetic acid to autoclaving, aeration, and light illumination. Agr. Biol. Chem. 43:879-880.
Trâm Anh
SBC Scientific