Nhân giống invitro hoa Cúc Đồng Tiền Gerbera jamesonii. Cúc Đồng Tiền nở quanh năm, nở rộ vào đầu hè và cuối thu. Nhân nhanh invitro sử dụng mẫu lá, cuống hoa, cuống lá. Môi trường nhân giống hoa cúc invitro là MS.
Từ khóa: Gerbera jamesonii , capitulum, leaf, in vitro regeneration
Nhân nhanh chồi in vitro được mô tả sử dụng phần capitular và mẫu lá ở Cúc Gerbera jamesonii. Ba chế độ môi trường cơ bản được sử dụng bao gồm MS và hai dạng cải tiến – MSI và MSA. Cảm ứng chồi đạt được ở ba chế độ nhưng môi trường MSI bổ sung Kn (4mg/L) và IAA (0.5mg/L) là lý tưởng cho sự hình thành chồi (8-11) từ vùng capitular và Kn (4mg/L) và IAA (0.1 mg/L) từ lá (5-8 chồi). Môi trường MSI với 2mg/L Kn+0.5mg/L PAA được dung để nhân nhanh mô sẹo có khả năng phát sinh cơ quan; 20-25 chồi phát triển trên mô sẹo này. Hình thành rễ từ chồi in vitro đạt được trên môi trường MS với 0.5 mg/L IAA. Cây con được chuyển ra chậu để phát triển và ra hoa.
Giới thiệu
Cúc Gerbera jamesonii là loài hoa cắt cành thương mại quan trọng. Nó là một trong mười loài hoa thương mại trên thế giới. Nhân giống thực vật chậm và các phương pháp nhân giống thông thường không cung cấp sản phẩm đủ với số lượng lớn các cá thể đồng nhất cho trồng trọt thương mại [1]. Trong những năm qua, nhiều người đã cố gắng nhân giống nuôi cấy mô ở Gerbera từ nhiều nguồn mẫu khác nhau như chồi đỉnh [2], hoa nở [3-7] và tiểu noãn [8-9]. Nhu cầu cây nuôi cấy mô tăng nhiều so với sản xuất cây thông thường. Trong bài báo này, các tác giả đã nỗ lực thành công trong tái sinh từ mẫu cuống hoa(capitulum), lá và chồi in vitro. Từ một mẫu cuống hoa, thu được 2200 chồi trong 13 tuần, với hệ số nhân cao nhất cho đến nay.
Vật liệu và phương pháp nghiên cứu
Cây trưởng thành đạt được lấy từ giống hoa đơn thông thường mùa vàng đạt được từ vườn ươm Pushpawali, Jaipur. Lá (1.5-2.8 cm) với cuống lá và cuống hoa( capitulum )(0.3-0.7 cm đường kính) tại giai đoạn chưa mở được lấy từ cây phát triển trong chậu. Chồi in vitro được nuôi trong môi trường tái sinh chồi.
Lá non và cuống hoa chưa nở được thu nhận từ các cây trong chậu. Chúng được rửa dưới vòi nước chảy sau đó được rửa với chất tẩy rửa Extran (20% v/v). Các mẫu được khử trùng bề mặt với dung dịch thủy ngân chloride 0.1%(w/v) trong 3 phút và rửa với nước cất vô trùng ít nhất 5 lần. Sau khi khử trùng, cuống hoa được cắt thành 20 miếng, lá giữ nguyên. Ở Gerbera, thân đặc, nhẹ và lá mọc ra từ thân có cuống dài, thân này được gọi là thân lõi. Từ nuôi cấy tăng trưởng, phần thân lõi với lá được tách ra. Lá được cắt ra và thân lõi được dùng để nuôi cấy. Mười hai mẫu tái tạo cho mỗi mẫu ban đầu thu được từ mỗi nghiệm thức. Nuôi cấy hình thành từ các mẫu này trong thời gian cấy chuyền được chia thành các mẫu xấp xỉ 500mg.
Môi trường dinh dưỡng được chọn cho nghiên cứu này là: I, Murashige và Skoog’s (1962) [10] với 30g/L sucrose – (MS); II, ½ MS đa lượng + vi lượng Heller+80mg/L adenine sulphate và sucrose (10-40 g/L) – (MSA); và III, muối MS với nồng độ thay đổi của MnSO4, MgSO4, ZnSO4 và Thiamin HCl, Pyridoxine HCl, Nicotinic acid với thêm Tyrosine, Adenine sulphate, NaH2PO4 và 30g/L sucrose - (MSI).
Các loại auxin (IAA, IBA, NAA, PAA, 2,4-D) và cytokinin (Kn và BAP) khác nhau được kết hợp trong các môi trường được đề cập ở trên riêng lẻ hay kết hợp. pH môi trường được chỉnh về 5.8 và làm đông với 0.8% agar. Môi trường MS, MSA, MSI kết hợp với BAP hay Kn được dùng cho cảm ứng mô sẹo và nhân chồi. Tạo mô sẹo trên các sự kết hợp khác nhau được chuyển trên môi trường MS và MSA với BAP (2.4 mg/L) + IAA (0.1 mg/L) và adenine sulphate hay MSI với 4 mg/L Kn và 0.5 mg/L IAA cho khởi đầu tạo chồi. Nuôi cấy đạt được từ mẫu được cấy chuyền thường để duy trì và nhân chồi. Nhân chồi lúc sau được tiến hành trên môi trường MSI với 2mg/L Kn + 0.5 mg/L PAA.
Chồi được tái sinh (>2.5 cm) được tách riêng và chuyển sang môi trường tạo rễ. Môi trường MS bổ sung IBA, IAA (0.2-0.5mg/L) được dùng để tạo rễ. Cây con phát triển hoàn chỉnh vể hệ thống rễ được chuyển ra chậu chứa rêu than bùn và đất vườn (1:1).
Dữ liệu được phân tích bởi phân tích phương sai 1 chiều (ANOVA) và so sánh giữa các giá trị có nghĩa của các nghiệm thức được thực hiện bằng kiểm tra khác biệt có ý nghĩa thấp nhất (LSD).
Kết quả và thảo luận
Hiệu quả của môi trường muối cơ bản
Môi trường muối cơ bản dùng cho nghiên cứu tái sinh Gerbera jamesonii được thay đổi nhiều lần trong các nghiên cứu khác nhau. Murashige et al [2] dùng môi trường MS với cải tiến khi Huang và Chu [3] chỉ dùng môi trường MS. Laliberte et al [11] dùng vi lượng của Heller. Trong cảm ứng chồi từ phần cuống hoa. Các tác giả cũng dùng kết hợp đa lượng MS và vi lượng Heller với nhiểu thay đổi trong thành phần bổ sung (MSA) nhưng điều này không hiệu quả như cải tiến của MS bên cạnh các chất cho thêm vào (MSI). Trong nghiên cứu này, MS, MSA vaf MSI được dùng và cho kết quả tốt nhất trong tất cả ba loại mẫu khi quan sát trên môi trường MSI (Bảng 1). Môi trường MSA cải thiện hình thành từ mô sẹo từ đế hoa của mẫu cuống hoa và phần phình to của hoa được cũng khởi đầu tạo mô sẹo sau 2 tuần. Môi trường MSI duy trì hình thành và nhân mô sẹo tốt nhất. MS cho kết quả trung bình.
Hiệu quả của hormon tăng trưởng
Cuống hoa Capitulum
Phần cuống hoa capitula khi nuôi cấy trên 3 chế độ môi trường muối cơ bản tăng cường với các auxin khác nhau (IAA, IBA, PAA, NAA, 2,4-D) ở các nồng độ khác nhau (0.1-5 mg/L) cảm ứng mô sẹo. Cảm ứng mô sẹo bắt đầu từ vết cắt của phần cuống hoa . Mặc dù cả ba môi trường cảm ứng mô sẹo xảy ra nhưng hình thành mô sẹo cao nhất (xấp xỉ 800 mg) xảy ra trên môi trường MSI (Bảng 1). Mô sẹo mềm hơi xanh chuyển sang nâu sau 4 tuần. Hình thành rễ được quan sát trên IAA (0.1-2 mg/L) và IBA (2-3 mg/L) khi bổ sung vào môi trường. Hình thành rễ xảy ra trên vết cắt của phần cuống hoa. Ở IAA chiều dài rễ đạt tới 7 cm trong khi ở ABA rễ chỉ 2-3 cm và phủ rễ tơ.
Mô sẹo phát sinh cơ quan (Hình 1A) được hình thành khi phản ứng với BAP hay Kn (-5 mg/L) _ IAA (0.1-0.5 mg/L) hay PAA (0.1mg/L) và cảm ứng chồi được quan sát trong 6-8 tuần. Kết hợp của IAA (0.1, 0.5 mg/L) với BAP (5 mg/L) và 80 mg/L adenine sulphate trong môi trường MSA cảm ứng đến 5 chồi từ phần cuống hoa. Sự kết hợp tương tự của BAP và IAA trên môi trường MSI cho ít hiệu quả và cảm ứng chỉ 2-3 chồi. Trong nghiên cứu này, hiệu quả của Kn được tìm thấy cao hơn BAP trong sự kết hợp với IAA. Tuy nhiên, Mandal và Datta [4] báo cáo sự tái sinh của các đầu hoa (flower heads) trong sự kết hợp BAP và IAA. Trong tài liệu, sự tái sinh được báo cáo chung khi dùng BAP hay Kn cùng với IAA. Trong báo cáo này chúng tôi nghiên cứu hiệu quả của PAA với BAP và Kn và quan sát một số cải thiện đáng chú ý. Chồi hình thành trên môi trường bổ sung PAA và BAP hay Kn thì nhỏ và thủy tinh thể trong hình thái học ban đầu (Hình 1C) nhưng sau khi cấy chuyền trên môi trường MSI bổ sung Kn (4mg/L) và PAA (0.1 mg/L) các chồi này phát triền thành chồi bình thường xấp xỉ 10 trong số (10 in number). Mô sẹo quan sát từ sự kết hợp khác nhau với các chồi ban đầu hay chồi bất thường được chuyển lên môi trường MSI với 4 mg/L Kn và 0.5 mg/L IAA cho khôi
phục chồi và nhân nhanh sau này.
Rất nhiều người sử dụng mẫu cuống hoa để tạo mô chồi invitro, cho tỉ lệ tái sinh cao. Pierik và cộng sự[5]chia 4 cuống hoa trưởng thành và từ 1 cuống hoa tạo ra 8-12 chồi trong 8 tuần. Laliberte và cộng sự[11] cũng dùng cuống hoa đạt được 4-5 chồi cho mỗi phần và trong quá trình cấy chuyền đạt được 8-10 chồi từ các phần này. Các tác giả cũng dùng cuống hoa chưa trưởng thành và tìm thấy trên môi trường MSI với 4mg/L Kn và IAA (0.1-0.5 mg/L) 200 chồi được tạo ra trong 8 tuần và 2200 chồi có thể đạt được trên MSI và Kn (2mg/L)+PAA(0.1, 0.5 mg/L) trong 13 tuần.
Bảng 1- Hiệu quả của các chế độ môi trường trong giai đoạn bắt đầu hình thành chồi từ phần lá, capitulum và chồi in vitro G. jamesonii (khoảng thời gian nuôi cấy 6-8 tuần)
Hình 1. Tái sinh in vitro của G.Jamesonii: (A) Hình thành mô sẹo từ mẫu capitulum trên môi trường MSI bổ sung Kn(4 mg/L) và IAA (0.1 mg/L); (B) Phát triển chồi trên môi trường MSI với Kn(4 mg/L) và IAA (0.1 mg/L); (C) Hình thành mô sẹo và chồi bất thường trên môi trường MSI với Kn(4 mg/L) và PAA (0.1 mg/L); (D) Nhân chồi trên môi trường MSI với Kn(2 mg/L) và IAA (0.1 mg/L);(E ) Hình thành rễ của chồi trên môi trường MSI với 0.5mg/L IAA.
Lá
2,4-D (1-2 mg/L) bổ sung vào môi trường ban đầu hình thành mô sẹo từ lá. BAP hay Kn (0.5-5 mg/L) hỗ trợ việc tạo sẹo và tăng độ dày, cuối tuần thứ 4 chúng bắt đầu ở vết cắt nhưng không quan sát thấy sự hình thành mô sẹo. Hình thành mô sẹo được quan sát khi kết hợp BAP (2-5 mg/L) hay Kn (2-5 mg/L) với IAA (0.1-1.0 mg/L) hay PAA (0.1-0.5 mg/L) trong môi trường. Trong thời gian mô sẹo ban đầu đã xanh nâu và chắc chắn. Môi trường MSA không duy trì sự tăng trưởng tốt của lá khi so với MS và MSI. MSI thúc đẩy tăng sinh mô sẹo mềm xanh hóa vàng và mọng nước hóa đen sau 3 tuần và vì thế, nó cần cấy chuyền thường xuyên trong khoảng thời gian 2-3 tuần. Môi trường MS duy trì tăng trưởng mô sẹo xanh sang xanh đen, vốn khó hơn các mô sẹo hình thành trên MSI. Phát sinh chối được quan sát trên môi trường với 4mg/L BAP và 0.1 mg/L IAA thêm vào với 80 mg/L adenine sulphate 2-3 chồi được thấy sau 12 tuần duy trì trong nuôi cấy 20%. Các chồi này không dài hay tăng trong số các sự kết hợp vì vậy nuôi cấy được chuyển sang sự kết hợp khác như BAP (2-5 mg/L) với IAA (0.1-0.5 mg/L) và Kn(2-5 mg/L) với IAA(0.1-0.5 mg/L). Kn (4 mg/L) và 0.1 mg/L IAA thúc đẩy nhân nhanh (8-10) và kéo dài (1-3 cm) chồi. Trên môi trường MSI với 4mg/L Kn và 0.1 mg/L IAA sự hình thành chồi (5-8) đạt được sau 12 tuần và khi cấy chuyền thường xuyên số chồi tăng lên (8-10). Mẫu lá chậm khi bị tác động nhân chồi khi so với cuống hoa và trái ngược với báo cáo bởi Jerzy và Lubomski [12]họ yêu cầu cả cytokinin và auxin cho hình thành chồi.
Chồi in vitro
Từ nuôi cấy tăng sinh, lá được cắt và thân lõi được dùng cho nuôi cấy trên môi trường MS và MSI với sự kết hợp khác nhau của BAP hay Kn (5mg/L) và IAA, IBA, NAA, PAA (0.1, 0.5 mg/L) có hay không adenine sulphate. Mức nhân nhanh đến 8-15 chồi từ 1 chồi in vitro sau mỗi 4 tuần trên môi trường MSI với 4 mg/L Kn và 0.1, 0.5 mg/L IAA. Kn tốt hơn cho nhân chồi hơn BAP. Mô sẹo đạt được trên môi trường MS là các nốt xanh đen khi mô sẹo trên môi trường MSI xanh sáng và số lượng nhiều hơn trên môi trường MS [12].
Duy trì nuôi cấy
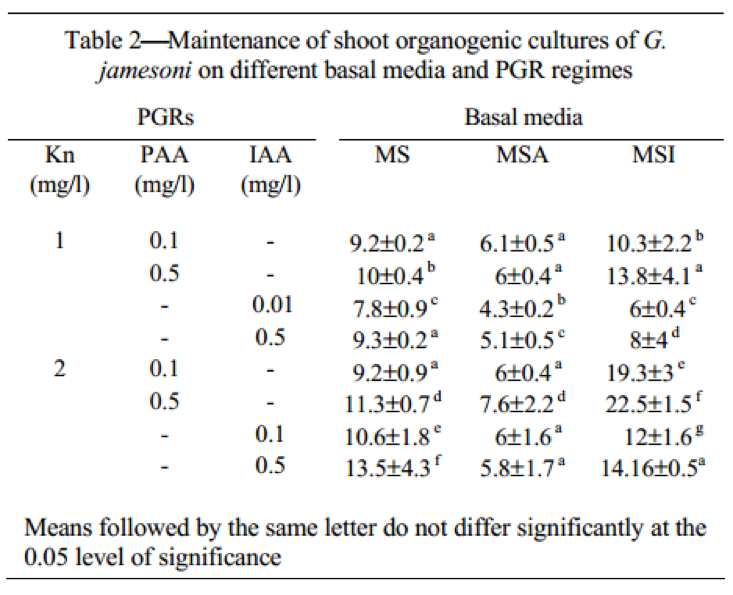
Nuôi cấy từ các loại mẫu được cấy chuyền thường xuyên để duy trì và nhân nhanh chồi. Trong quá trình cấy chuyền cẩn thận được tiến hành để loại mô nhạt màu và hoại tử, vì sự hiện diện của chúng ức chế nuôi cấy. Cho nhân nhanh chồi môi trường MSI với 4mg/L Kn và 0.5 mg/L IAA được dùng. Mô sẹo đạt được từ các sự kết hợp khác nhau với các chồi khởi đầu hay chồi bất thường được chuyển trên môi trường MS hay MSI với 4 mg/L Kn và 0.5 mg/L IAA cho phục hồi chồi và nhân nhanh sau này. Ban đầu, sự kết hợp này được dùng cho nhân nhanh. IAA là auxin chính, được báo cáo để duy trì tái sinh chồi ở các nghiên cứu nuôi cấy mô G.jamesonii [2, 4, 11]. Các tác giả quan sát thầy phần từ IAA, PAA cũng duy trì khởi đầu chồi. Vì vậy, hiệu ứng này duy trì nuôi cấy được kiểm tra và BAP hay Kn (2,4 mg/L) được kết hợp với PAA (0.05-2.5 mg/L) khi Kn được hiệu quả hơn với PAA (Bảng 2) hơn BAP. Trong nuôi cấy 2 mg/L Kn + 0.5 mg/L PAA nhân nhanh và 20-25 chồi phát triển (Hình 1D); 12-25 chồi được quan sát trong nuôi cấy phát sinh cơ quan với 2 mg/L Kn và 0.1 mg/L PAA. Hiệu quả của PAA trong cải tiến sự kéo dài và khôi phục chồi bình thường được thiết lập trong các hệ thống thực vật khác như Phaseolus vulgaris [13], Capsicum annuum [14] và Helianthus annuus [15]. Trong nghiên cứu nà, PAA cho thấy sự cải thiện trong nhân chồi và tạo điều kiện hồi phục chồi khỏe mạnh. Các nuôi cấy thường xuyên cấy chuyền trong 2 năm. Trong nghiên cứu này 1 cuống hoa được tách thành 20 miếng, mỗi miếng tạo ra trung bình 10 chồi sau 6 tuần. Vì vậy từ 1 cuống 200 chồi được tạo thành trong 8 tuần. Mỗi trong 20 nuôi cấy được tách thành 4 nuôi cấy sau 8 tuần và mỗi nuôi cấy cho trung bình 13.8 chồi trên môi trường MSI với Kn và IAA và 22.4 chồi trong môi trường bổ sung Kn và PAA trong 5 tuần. Như kết quả một cuống hoa sẽ tạo thành 200 chồi trong 8 tuần và sau đó là 2000 chồi sau 5 tuần.
Hình thành rễ và cây con
Hình thành rễ được quan sát trên môi trường MSI bổ sung các mức IAA khác nhau. Trên môi trường chứa 0.5 mg/L IAA rễ được hình thành tốt nhất trong 4 tuần (Hình 1E). Tuy nhiên, hình thành rễ trên môi trường cơ bản không hormon đã được quan sát [4]. Cây con được chuyển vào chậu chứa rêu than bùn và đất vườn nơi chúng sống và phát triển đến khi trưởng thành. Quy trình tái sinh này có thể sử dụng để đạt được số lượng cây con lớn từ các cây hoa có giá trị.
Lời cảm ơn
Công việc này được tài trợ bởi chương trình CSIR No 38(900)/95/EMR II.
Tài liệu tham khảo
Purnima Tyagi và SL Kothari *
Khoa Thực vật học, Đại học Rajasthan, Jaipur 302 004, Ấn Độ
1 Das P & Singh SPK, Gerbera in Commercial flowers, edited by TK Bose and LP Yadav (Naya Prokashan, Kolkata) 1989, 601-622.
2 Murashige T, Serpe M & Jones JB, Clonal multiplication of Gerbera through tissue culture, Hortsci , 9 (1974) 175-180.
3 Huang MC & Chu CY, A scheme for commercial multiplication of gerbera ( Gerbera hybrida Hort) through shoot tip culture, J JPN Soc Hortic Sci , 54 (1985) 94-100.
4 Mandal AKA & Datta SK, Introduction ofGerbera cultivation in Lucknow Agro-climate through tissue culture of young flower heads, Indian J Biotechnol , 1 (2002) 212-214.
5 Pierik RLM, Steegmans HHM, Verhaegh JAM & Wouters, Effect of cytokinin and cultivar on shoot formation of Gerbera jamesonii in vitro, Neth J Agric Sci , 30 (1982)341-346.
6 Pierik RLM, Steegmans HHM & Maredis JJ, Gerbera plantlets from in vitro cultivated capitulum explants, Sci Hort , 1 (1973) 117-119.
7 Pierik RLM, James JLM, Maasdam A & Binnendij K, Optimization of Gerbera plantlet production from excised capitulum explants, Sci Hort , 3 (1975) 351-357.
8 Cagnet-Sitbon M, Recherches peliminaires sur la production d'haploides de Gerbera jamesonii par culture d'anthers et d'ovules non fecondes in vitro , Theses de 3e cycle. Plantes Universite Paris-Sud ., Centre d Orsay (1980).
9 Meynet J & Sibi M, Haploid plants from in vitro cultures of unfertilized ovules of Gerbera jamesonii, Z Pflanzenzuchtg , 93 (1984) 78-85.
10 Murashige T & Skoog F, A revised medium for rapid growth and bioassays with tobacco tissue cultures, Physiol Plant , 15 (1962) 473-497.
11 Laliberte S, Chretien L & Vieth J, In vitro plantlet production from young capitulum explants of Gerbera jamesonii Hortsci, 20 (1985) 137-139.
12 Jerzy M & Lubomski M, Adventitious shoot formation fromex vitro derived leaf explants of Gerbera jamesonii, Scientia Hortic , 47 (1991) 136-143.
13 Small DK & Morris DA, Promotion of elongation and acid invertase activity in Phaseolus vulgaris L. internode segments by phenyl acetic acid, Plant Growth Regulat , 9(1990) 329-340.
14 Husain S, Jain A & Kothari SL, Phenyl acetic acid improves bud elongation and in vitro plant regeneration efficiency in Capsicum annum L., Plant Cell Rep , 19 (1999) 64-68.
15 Dhaka N & Kothari SL, Phenyl acetic acid improves bud elongation and in vitro plant regeneration efficiency in Helianthus annuus L., Plant Cell Rep , 21 (2002) 29-34.
Lưu ý:

Trâm Anh
SBC Scientific
Hotline: 0945677929
Email: info@sbc-vietnam.com