Sử dụng polyamine trong nuôi cấy mô nhằm tăng cường khả năng tái sinh thực vật, đã gia tăng trong những năm gần đây. Trong nghiên cứu này cho thấy sự kết hợp giữa cytokine (BAP hoặc TDZ) và polyamine (Put) có ảnh hưởng ở những mức độ khác nhau. Sự trương phồng lên của tế bào đã diễn ra trong suốt giai đoạn nuôi cấy ban đầu, và hình thành nên cấu trúc rosette và tạo ra nhiều chồi (hình 1 H-K). Ảnh hưởng mạnh nhất lên sự khởi phát chồi (5,8 ± 0,44) diễn ra trên môi trường có TDZ (4,54 µM) và Put (5,6 µM) (hình 2). Khi nồng độ TDZ và Put cao hơn sẽ làm giảm sự tạo chồi, nhưng lại gia tăng hình thành RLS. Số lượng RLS nhiều nhất được quan sát thấy trong môi trường có TDZ 36,32 µM) và Put (1,13 µM). Khi bổ sung BAP (17,6 µM) và Put (11,3 µM) cũng ảnh hưởng đến nhân chồi, sau 6 tuần nuôi cấy có 3.4 ± 0.19 chồi hình thành (Hình 3). Khi nồng độ BAP thấp hơn kết hợp với Put sẽ làm cho tế bào trương phồng lên và không hình thành chồi, được thể hiện ở hình 1H. Chồi được tái sinh được chuyền vào môi trường chứa 5.7 µM IAA để cho ra rễ. Mặc dù cây khỏe và ra rễ tốt, nhưng không có sự phát sinh thêm chồi mới trong môi trường ra rễ.
|
Môi trường khởi phát PGR (µM) |
Hình thành cấu trúc hoa hồng thông qua GLS và BLS sau 3 tuần |
Số lượng chồi dài ra sau 6 tuần |
MS + IAA (µM) |
Sau 4 tuần cấy chuyền |
|
GLS |
BLS |
Hình thành of RLS Sau 5 tuần |
Số lượng chồi dài ra |
Số lượng rễ |
Chiều dài rễ (cm) |
|
Đối chứng |
≠ |
≠ |
≠ |
≠ |
≠ |
≠ |
≠ |
≠ |
|
|
|
|
|
0,0 |
≠ |
≠ |
≠ |
|
BAP 4,44 |
S |
S |
S |
≠ |
2,85 |
≠ |
≠ |
≠ |
|
|
|
|
|
5,70 |
≠ |
≠ |
≠ |
|
|
|
|
|
11,40 |
≠ |
≠ |
≠ |
|
|
|
|
|
0,0 |
≠ |
≠ |
≠ |
|
8,88 |
++ |
+ |
+ |
≠ |
2,85 |
≠ |
≠ |
≠ |
|
|
|
|
|
5,70 |
≠ |
≠ |
≠ |
|
|
|
|
|
11,40 |
≠ |
≠ |
≠ |
|
|
|
|
|
0,0 |
≠ |
≠ |
≠ |
|
17,76 |
+++ |
++ |
++ |
≠ |
2,85 |
1,5 ± 0,55de |
2,6 ± 0,24gh |
0,4 ± 0,04l |
|
|
|
|
|
5,70 |
2,0 ± 0,45de |
5,2 ± 0,37def |
2,0 ± 0,04bcd |
|
|
|
|
|
11,40 |
1,3 ± 0,45e |
6,6 ± 0,40bcde |
0,5 ± 0,05kl |
|
|
|
|
|
0,0 |
2,0 ± 0,57de |
≠ |
≠ |
|
35,52 |
+ |
+++ |
+++ |
|
2,85 |
1,6 ± 0,45de |
3,8 ± 0,37fgh |
1,1 ± 0,05hi |
|
|
|
|
2,0 ± 0,57a |
5,70 |
5,2 ± 0,39bc |
7,4 ± 0,24bcd |
2,1 ± 0,05bcd |
|
|
|
|
|
11,40 |
3,0 ± 0,45cde |
10 ± 0,44a |
1,0 ± 0,04ij |
|
|
|
|
|
0,0 |
1,2 ± 0,25e |
≠ |
≠ |
|
71,044 |
+ |
++ |
++ |
|
2,85 |
2,6 ± 0,45de |
2,4 ± 0,24h |
1,4 ± 0,04fg |
|
|
|
|
1,2 ± 0,25a |
5,70 |
3,2 ± 0,35de |
5,2 ± 0,20def |
2,0 ± 0,04bcd |
|
|
|
|
|
11,40 |
1,5 ± 0,39e |
7,6 ± 0,24bc |
1,9 ± 0,08cde |
|
|
|
|
|
0,0 |
≠ |
≠ |
≠ |
|
TDZ 2,27 |
+ |
+ |
+ |
|
2,85 |
≠ |
≠ |
≠ |
|
|
|
|
≠ |
5,70 |
≠ |
≠ |
≠ |
|
|
|
|
|
11,40 |
≠ |
≠ |
≠ |
|
|
|
|
|
0,0 |
≠ |
≠ |
≠ |
|
4,54 |
++ |
+ |
+ |
|
2,85 |
1,3 ± 0,45e |
3,6 ± 0,24fgh |
0,7 ± 0,03k |
|
|
|
|
≠ |
5,70 |
2,7 ± 0,39de |
6,4 ± 0,24bcde |
2,2 ± 0,06abc |
|
|
|
|
|
11,40 |
1,5 ± 0,55de |
5,2 ± 0,58def |
1,2 ± 0,03ghi |
|
|
|
|
|
0,0 |
≠ |
≠ |
≠ |
|
9,08 |
+++ |
++ |
++ |
|
2,85 |
1,6 ± 0,45de |
2,4 ± 0,24h |
1,0 ± 0,02ij |
|
|
|
|
≠ |
5,70 |
3,5 ± 0,55bcde |
6,2 ± 0,73cde |
2,2 ± 0,10ab |
|
|
|
|
|
11,40 |
1,5 ± 0,55de |
4,8 ± 0,96efg |
1,6 ± 0,14ef |
|
|
|
|
|
0,0 |
1,6 ± 0,25de |
≠ |
≠ |
|
18,16 |
++ |
+++ |
+++ |
3,0 ± 0,57a |
2,85 |
4,0 ± 0,55bcd |
5,2 ± 00,58def |
1,3 ± 0,05fgh |
|
|
|
|
|
5,70 |
9,5 ± 0,39a |
8,6 ± 0,50ab |
2,4 ± 0,02a |
|
|
|
|
|
11,40 |
6,0 ± 0,45b |
10,2 ± 0,48a |
1,2 ± 0,02ghi |
|
|
|
|
|
0,0 |
1,6 ± 0,25de |
≠ |
≠ |
|
36,32 |
+ |
++ |
++ |
1,6 ± 0,25a |
2,85 |
2,2 ± 0,39de |
2,2 ± 0,20h |
0,7 ± 0,02fgh |
|
|
|
|
|
5,70 |
4,0 ± 0,45bcd |
5,2 ± 0,20def |
1,8 ± 0,02a |
|
|
|
|
|
11,40 |
2,0 ± 0,39de |
8,6 ± 0,24ab |
1,1 ± 0,02ghi |
PGR: chất điều hòa sinh trưởng thực vật; GLS: cấu trúc như hình cầu; BLS: Cấu trúc như chồi; ≠ : không có biểu hiện; S: trương phồng lên; + : thấp; ++: trung bình; +++ : cao; Giá trị trung bình ± SE. Giá trị trung bình được theo sau bởi những chữ cái giống nhau thì không có khác biệt đáng kể, theo Turkey test HSD

Hình 2. Ảnh hưởng của thidiazuron và putrescine lên sự khởi phát chồi từ lá mầm của Capsicum chinense Jacq. (Ớt Naga king) trong môi trường MS. Dữ liệu được ghi nhận sau 6 tuần nuôi cấy. Kiểm định Tukey’s post-hoc cho thấy giá trị trung bình không khác biệt đáng kể giữa các nhóm, thể hiện qua các chữ cái giống nhau.
3.3 Cho cây tái sinh thích nghi với môi trường
Cây con đã ra rễ in vitro sau 4 tuần, có ít nhất 2 rế dài từ 0,4-2,4 cm được rửa cẩn thận bằng nước và chuyển ra chậu chứa hỗn hợp đất và phân chuồng trại (3:1). Cây có hệ rễ phát triển tốt thích hợp để chuyển sang giai đoạn làm cây cứng cáp. Điều này sẽ tạo điều kiện thuận lợi giúp cho cây phát triển mạnh mẽ. Khoảng 90% cây còn sống trong điều kiện nhà kính và tương tự nhau về hình thái. Tuy nhiên, bởi vì cây ra rễ ở các nồng độ IAA khác nhau được trồng chung với nhau, nên không thể xác định được ảnh hưởng của nồng độ auxin khác nhau lên quá trình thích nghi. Những cây cứng cáp được trồng ra đất và cho quả bình thường (Hình 1L và M).
3.4 Tách chiết, định danh và định lượng
Trong thí nghiệm này, việc xác định capsaicinoid sử dụng phương pháp sắc kí lỏng hiệu năng cao HPLC, bởi vì đây là phương pháp tách chiết có thời gian phân tích ngắn và hiệu quả cao, đơn giản, nhanh chóng và chính xác. Hiệu quả tách, định danh và định lượng capsaicinoid từ quả ớt chín có nguồn gốc in vitro và in vivo, bằng HPLC được thể hiện trong hình 4. Hàm lượng capsaicin trong ớt chín có nguồn gốc in vitro là 0,05236 g/g – tính theo khối lượng khô (837,760 SHU), trong khi đó hàm lượng này đối với ớt in vivo là 0,0545 g/g – tính theo khối lượng khô (872,000 SHU).
Hình 3. Ảnh hưởng của 6-benzylaminopurine và putrescine lên sự khởi phát chồi từ lá mầm của Capsicum chinense Jacq. (Ớt Naga king) trong môi trường MS. Dữ liệu được ghi nhận sau 6 tuần nuôi cấy. Kiểm định Tukey’s post-hoc cho thấy giá trị trung bình không khác biệt đáng kể giữa các nhóm, thể hiện qua các chữ cái giống nhau. Cấu trúc rosette (+: thấp, ++ : trung bình; +++: cao), S = trương phồng
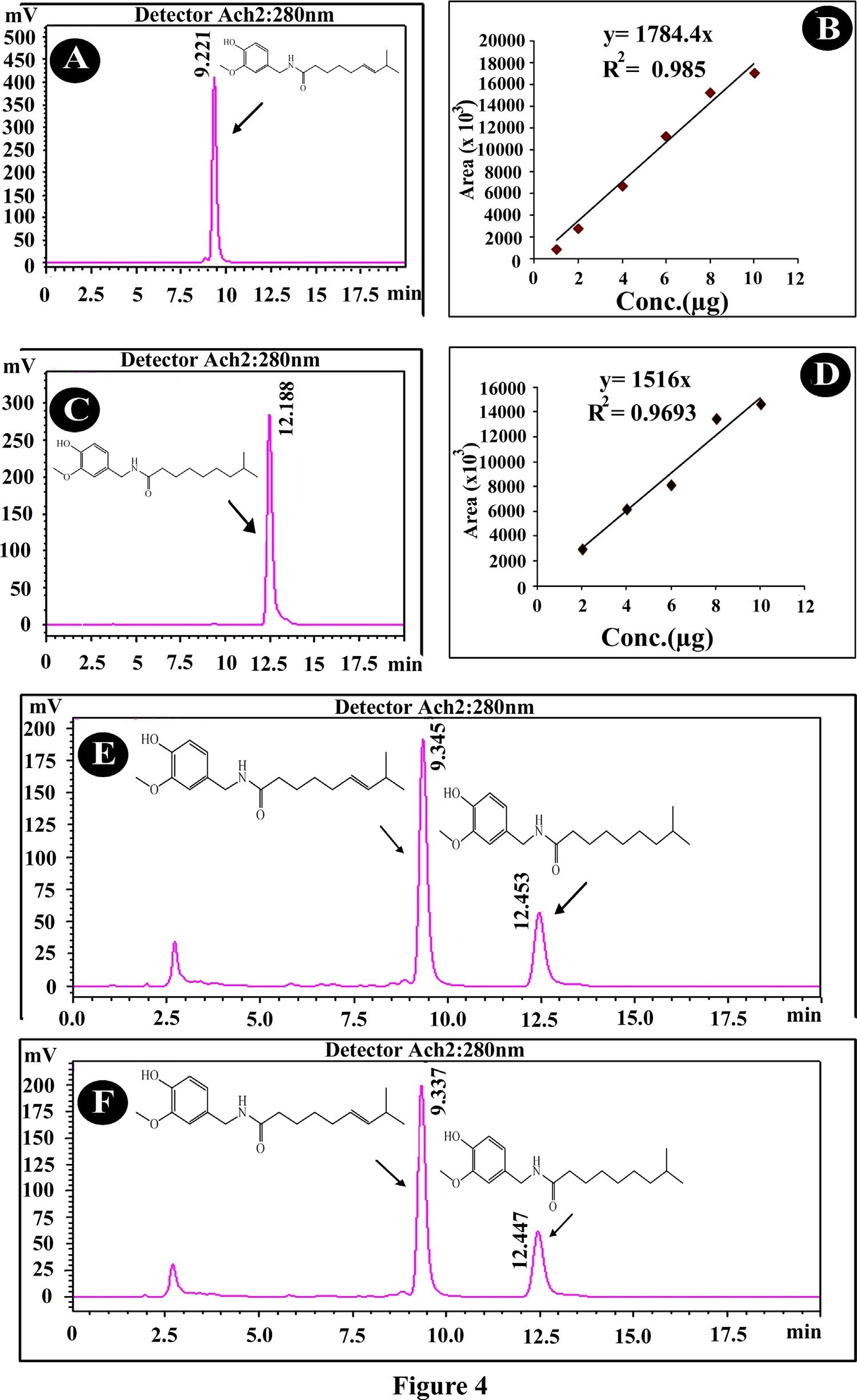
Hình 4. Sắc kí đồ sắc kí lỏng hiệu năng cao tại bước sóng 280 nm (A) Sắc kí đồ HPLC của capsaicin chuẩn (9,32 phút). (B) Đường chuẩn của capsaicin ở các nồng độ khác nhau. (C) Sắc kí đồ HPLC của dihydrocapsaicin (12,46 phút) (D) Đường chuẩn của dihycapsaicin ở các nồng độ khác nhau. (E) ) Capsaicin (9,32 phút) và Dihydrocapsaicin (12,43 phút) từ mẫu quả ớt nhân giống in vivo (F) Capsaicin (9,32 phút) và Dihydrocapsaicin (12,43 phút) từ mẫu quả ớt nhân giống in vivo.
4. Thảo luận
Mặc dù cây ớt có tầm quan trọng trong kinh tế, nhưng hế thống tái sinh cây in vitro cho loài Capsicum không phát triển nhanh như những loài khác trong họ Solanacea. Trong trường hợp các thành viên của loài Capsicum, rất khó để tái ính được toàn bộ cây từ mẫu vật hoặc các mô khác (Ochoa-Alejo và Ramirez-Malagon, 2001).Việc tái sinh cây in vitro thông qua sự phát sinh cơ quan bất định ở loài Capsicum thì không mang lại thành công do tạo ra chồi không rõ rang, bị còi cọc, lá biến dạng theo kiểu hình thái của súp lơ trắng (Liu và cộng sự 1990). Tuy nhiên, trong những năm gần đây, đã có nhiều báo cáo nghiên cứu về các kiểu gen của ớt (Ochoa-Alejo và Ramirez-Malagon, 2001; Venkataiah và cộng sự, 2003; Kumar và cộng sự, 2005; Valera-Montero và Phillips, 2005; Golegaonkar và Kantharajah, 2006; Mezghani và cộng sự, 2007; Sanatombi và Sharma, 2008a; Valadez-Bustos và cộng sự, 2009). Trong nghiên cứu này, chúng tôi, chúng tôi nhận thấy RLS có tiềm năng tái sinh cây từ lá mầm thấp. Quan sát này của chúng tôi phù hợp với các kết luận ở trước đó (Ochoa-Alejo và Ramirez-Malagon, 2001). Tuy nhiên, nhược điểm không tăng thêm chồi mới của RLS đã được khắc phục khi chuyền RLS vào môi trường chứa 5,7 µM IAA. Các phát hiện này của chúng tôi cho thấy rằng sự kết hợp của cytokinin (BAP và TDZ) trong môi trường đem lại kết quả là kích thích các cấu trúc có thể phát sinh cơ quan. Vai trò đặc biệt quan trọng của cytokinin trong việc kích thích hình thành các cơ quan đã được ghi nhận trong nuôi cấy mô tế bào của nhiều loại ớt (Christopher và Rajam, 1996; Venkataiah và Subhash, 2001). Trong nghiên cứu này, RLS cảm ứng tốt nhất trong môi trường chỉ bổ sung 18,16 µM TDZ. Cấu trúc này được chuyển sang môi trường chứa 5,7 µM IAA để tạo ra nhiều chồi, Ảnh hưởng của liều lượng thấp (1,0 µM TDZ) lên cảm ứng nhân chồi từ phần đốt của C. annuum đã được đưa ra trong các báo cáo trước đây (Ahmad và cộng sự, 2006), nhưng trong nghiên cứu này của chúng tôi với C. chinense, khi liều lượng TDZ cao hơn thì có ưu thế tạo ra các cấu trúc rosette từ lá mầm hơn. TDZ là chất điều hòa sinh trưởng tiềm năng, thể hiện vai trò của cytokinin trong hệ thống nuôi cấy bao gồm cả tạo cơ quan và tạo phôi vô tính đối với vài loài thực vật (Manoharan và cộng sự, 1998; Dolendro và cộng sự, 2003; Venkataiah và cộng sự, 2003; Ahmad và cộng sự, 2006). Hiệu quả của BAP trong việc khởi phát cấu trúc rosette cũng được quan sát trong nghiên cứu này. Khi chỉ có BAP, điều kiện tốt nhất cho khởi phát cấu trúc rosette là môi trường chứa 33,44 µM BAP. Mặc dù vài chồi (3,0 ± 0,57) có dài ra thêm trong môi trường chứa 18,16 µM TDZ hoặc 33,44 µM BAP, nhưng con số này vẫn thấp đáng kể. Số lượng chồi nhân lên nhiều chỉ sau khi chuyển sang môi trường có 5,7 µM IAA. Khi Put kết hợp với BAP hoặc TDZ trong môi trường, sẽ nhân nhiều chồi. Xử lý Put trong vài thí nghiệm cho thấy đã thúc đẩy chồi nhân lên (Chi và Pua, 1989). Khi kết hợp TDZ hoặc BAP với Put sẽ ảnh hưởng trực tiếp đến sự khởi phát chồi. Sự hiện diện của polyamine trong môi trường có ảnh hưởng trực tiếp đến sự nhân chồi ở cây bông vải, theo Ganesan và Jayabalan (2006). Tác dụng tăng cường của polyamine lên sự khởi phát nụ chồi là do chúng kích thích lên sự phân chia tế bào và hoặc ức chế sự sản sinh ethylene, theo Bais và cộng sự, (2000). Mặc dù chồi có nhân lên (5,8 ±0,44) trong môi trường chứa 4,54 µM TDZ và 5,6 µM Put, nhưng số lượng chồi vẫn thấp đáng kể, khi chuyền những chồi này sang môi trường chứa 5,7 µM IAA vẫn không phát triển thêm nụ chồi mới.
Capsaicinoid được tổng hợp trong tế bào biểu bì của quả loài Capsicum được tích tụ trong các vết phồng trên biểu bì (Suzuki và cộng sự, 1980), Khi quả chín, hàm lượng capsaicinoid đạt đến mức cao nhất. Độ cay phụ thuộc vào nhiều yếu tố chẳng hạn như giai đoạn phát triển của quả và điều kiện môi trường sinh trưởng (Lindsey và Bosland, 1995; Estrada và cộng sự, 1998; Zewdie và Bosland, 2000). Trong nghiên cứu này, chúng tôi nhạn thấy hàm lượng capsaicinoid của quả C. chinense chín của cây in vivo cao hơn cây in vitro; tuy nhiên, sự khác biệt này rất nhỏ. Nói chung, sự tích tụ các chất chuyển hóa thứ cấp của cây in vitro được biết là thấp hơn so với cây in vivo.
4.1 Kết luận
Nghiên cứu này cho thấy trong hai kiểu biểu hiện, BLS có tần suất tạo cấu trúc rosette cao hơn và cho kết quả tối ưu trong hình thành chồi hơn là GLS. Môi trường có Put, có ảnh hưởng trực tiếp đến sự khởi phát chồi hơn là tạo ra các cấu trúc rosette; tuy nhiên mức độ tạo chồi thấp hơn. Cây tái sinh sống tốt trong nhà kính. Xác định độ cay bằng sắc kí lỏng hiệu năng cao HPLC cho thấy quả ớt nhân giống in vitro có vị cay như ớt in vivo. Điều này có nghĩa là nhân giống in vivo hiệu quả hơn nhân giống truyền thống mà vẫn giữ được chất lượng của quả. Vì vậy, việc thiết lập một quy trình đầy hứa hiện cho tái sinh hiệu các mảnh lá mầm của loài C. chinense là rất hữu ích để tạo ra các biến thể dòng soma, nhân giống quy mô lớn các kiểu gen riêng biệt, bảo tồn và thực hiện các thao tác di truyền đối với loài này.
Lời cảm ơn
Mechuselie Kehie gửi lời cảm ơn đến Ủy ban tài trợ đại học Grant Commission (UGC) đã tặng học bổng cho ông Rajiv Gandhi. Ông cũng cảm ơn Tiến sĩ Dr. G.A. Ravishankar, ông H.B, Gururaj và cô P.M. Naveenchandra của Viên nghiên cứu trung tâm công nghệ thực phẩm Mysore (CFTRI), vì đã giúp đỡ để hoàn thành thành công nghiên cứu này,
TÀI LIỆU THAM KHẢO
Agrawal, S., Chandra, N., Kothari, S.L., 1989. Plant regeneration in tissue cultures of pepper (Capsicum annum L. cv Mathania). Plant Cell Tiss. Organ Cult. 16, 47–55. Aguado-Santacruz, G.A., Martínez-Castillo, A., Moreno-Gómez, B., Pen˜a- Mosqueda, D., 2004. Cultivo de tejidos vegetales. In: Aguado-Santacruz, G.A. (Ed.), XVI Jornada de ingeniería bioquímica. INIFAP, Unidad de Biotecnología-Instituto
Tecnológico de Celaya, Celaya, Gto. Mex, p. 55.
Ahmad, N., Siddique, I., Anis, M., 2006. Improved plant regeneration in Capsicum annum L. from nodal segments. Biol. Plant. 50, 701–704.
Arroyo, R., Revilla, M.A., 1991. In vitro plant regeneration from cotyledon and hypocotyls segments in two bell pepper cultivar. Plant Cell Rep. 10, 414–416.
Bais, H.P., Sudha, G.S., Ravishankar, G.A., 2000. Putrescine and silver nitrate influences shoot multiplication, in vitro flowering and endogenous titers of polyamines in Chichorium intybus L. cv. Lucknow Local. J. Plant Growth Regul. 19, 238–248.
Bhagowati, R.R., Changkija, S., 2001. Genetic variability and traditional practices in Naga King Chili landraces of Nagaland. Asian Agri.-Hist. 13, 171–180.
Chi, C.L., Pua, E.C., 1989. Ethylene inhibitor enhanced de novo shoot regeneration from cotyledons of B. campestris spp chinesis (Chinese cabbage) in vitro. Plant Sci. 64, 243–250.
Christopher, T., Rajam, M.V., 1996. Effect of genotype, explant and medium on in vitro regeneration of red pepper. Plant Cell Tiss. Organ Cult. 46, 245–250.
Dolendro, S.N., Sahoo, L., Bhalla, S.N., Jaiwal, P.K., 2003. The effect of TDZ on organo- genesis and somatic embryogenesis in pigeon pea (Cajanus cajan L Mill sp). Plant Sci. 164, 341–347.
Estrada, B., Pomar, F., Dıjaz, J., Merino, F., Bernal, M.A., 1998. Effects of mineral fertil-
izer supplementation on fruits development and pungency in “Padrojn” peppers.
J. Hortic. Sci. Biotechnol. 73, 493–497.
Evans, P.T., Malmberg, R.L., 1989. Do polyamines have a role in plant development?
Ann. Rev. Plant Physiol. Mol. Biol. 40, 235–269.
Ezura, H., 1997. Micropropagation of Capsicum species (pepper). In: Bajaj, Y.P.S. (Ed.), Biotechnology in Agriculture and Forestry High-tech and Micropropagation, vol.
39. Springer, Heidelberg, pp. 48–59.
Fierer, R.P., Mignon, G., Litvay, J.D., 1984. Arginine decarboxylase and polyamine required for embryogenesis in wild carrot. Sci. 223, 1433–1435.
Fiola, J.A., Hassan, M.A., Swartz, H.J., Bors, R.H., Mcnicol, R., 1990. Effect of thidi- azuron, light fluency rates and kanamycin on in vitro shoot organogenesis from excised rubus cotyledons and leaves. Plant Cell Tiss. Organ Cult. 20, 223–228.
Ganesan, M., Jayabalan, N., 2006. Influence of cytokinins, auxins and polyamines on in vitro mass multiplication of cotton (Gossypium hirsutum L. cv. SVPR2). Indian J. Exp. Biol. 44, 506–513.
Gerats, A.G.M., Keye, C., Collins, C., Malmberg, R.L., 1988. Polyamine level in Petunia genotypes with normal and abnormal floral morphologies. Plant Physiol. 86, 390–393.
Golegaonkar, P.G., Kantharajah, A.S., 2006. High-frequency adventitious shoot bud induction and shoot elongation of chili pepper (Capsicum annuum L.). In Vitro Dev. Biol. Plant 42, 341–344.
Guinness Book of World Records, 2006. Hottest Spice. www. guinnessworldrecords.com
Husain, S., Jain, A., Kothari, S., 1999. Phenylacetic acid improves bud elongation and in vitro plant regeneration efficiency in Capsicum annum L. Plant Cell Rep. 19, 64–68.
Hutchinson, M.J., Murch, S.J., Saxena, P.K., 1996. Morphoregulatory role of thidazuron: evidence of the involvement of endogenous auxin in thidiazuron- induced somatic embryogenesis of geranium (Perlargonium hortorum Baile).
J. Plant Physiol. 149, 573–579.
Kehie, M., Kumaria, S., Tandon, P., 2012. In vitro plantlet regeneration from nodal segments and shoot tips of Capsicum chinense Jacq. cv. Naga King Chili. 3 Biotech. 2, 31–35.
Khan, H., Siddique, I., Anis, M., 2006. Thidiazuron induced somatic embryogenesis and plant regeneration in Capsicum annum. Biol. Plant. 50, 789–792.
Kothari, S.L., Joshi, A., Kachhwaha, S., Ochoa-Alejo, N., 2010. A review on tissue culture and trangenesis. Biotechnol. Adv. 28, 35–48.
Kumar, V., Gururaj, H.B., Narasimha, Prasad, B.C., Giridhar, P., Ravishankar, G.A., 2005. Direct shoot organogenesis on shoot apex from seedling explants of Capsicum annuum L. Sci. Hortic.-Amsterdam 106, 237–246.
Lindsey, K., Bosland, P.W., 1995. A field study of environmental interaction on pun- gency. Capsicum Eggplant Newsl. 14, 36–38.
Liu, W., Parrott, W.A., Hildebrand, D.F., Cillins, G.B., Williams, E.G., 1990. Agrobac- terium induced gall formation in bell pepper (Capsicum annum L.) and formation of shoot like structure expressing introduced genes. Plant Cell Rep. 9, 360–364.
Manoharan, M., Sree Vidya, C.S., Lakshmi Sita, G., 1998. Agrobacterium-mediated genetic transformation in hot chili (Capsicum annuum L. var Pusa jwala). Plant Sci. 131, 77–83.
Mathew, D., 2002. In vitro shoot and root morphogenesis from cotyledon and hypocotyl explants of hot pepper cultivars Byadagi Dabbi and Arka Lohit. Cap- sicum Eggplant Newsl. 21, 69–72.
Meghvansia, M.K., Siddiquib, S., Haneef khana, M.D., Gupta, V.K., Vairalea, M.G., Gogoia, H.K., Singh, L., 2010. Naga chilli: a potential source of capsaicinoids with broad-spectrum ethnopharmacological applications. J. Ethnopharm. 132, 1–14. Mezghani, N., Jemmali, A., Elloumi, N., Gargouri-Bouzid, R., Kintzios, S., 2007. Mor- phohistological study on shoot bud regeneration in cotyledon cultures of pepper
(Capsicum annuum). Biol. Bratislava 62, 704–710.
Murashige, T., Skoog, F., 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15, 473–497.
Nuez, F., Gil-Ortega, R., Costa, J., 1996. El cultivo de pimientos, chiles y ajies. Mundi- Prensa, Mexico D.F., pp. p607.