Vi nhân giống cây Mấm ổi Avicennia marina có ý nghĩa quan trọng về mặt sinh thái, kinh tế và xã hội. Cây Mấm ổi phân bố ở vùng ven biển, giúp bảo vệ đất đai khỏi sạt lở. Từ khóa: Nuôi cấy mô, tái sinh rừng, Việt Nam, ACIAR, vi nhân giống, cây mấm.
Tóm tắt:
Cho tới nay, có rất ít các nghiên cứu liên quan đến vi nhân giống cây ngập mặn mặc dù chúng có ý nghĩa lớn về mặt kinh tế, sinh thái và xã hội ở nhiều nước. Vì các cây ngập mặn có rất ít cây con hoặc cây con có tuổi đời ngắn nên một quy trình vi nhân giống là rất cần thiết để đảm bảo giống cây trồng được cung cấp liên tục. Tuy nhiên, việc phát triển một phương pháp để khử sạch mẫu cấy của cây Mấm ổi Avicennia marina được trồng bên ngoài và trong nhà kính là rất khó khăn (<10% thành công). Tiến hành thí nghiệm trên đỉnh sinh trưởng và phần thân, sáu loại hóa chất khử trùng khác nhau đã được sử dụng nhưng chỉ có dung dịch thủy ngân clorua 0.1% là thành công duy nhất. Ngoài ra, phun lá với Benlate vài ngày trước khi thu lá cũng giúp cải thiện kết quả khử trùng tốt hơn.
Đỉnh sinh trường là phần dễ làm sạch nhất nhưng không đáp ứng tốt với các chất điều hòa tăng trưởng thực vật (PGRs) trong khi những mẫu thân có thể sống sót sau quá trình khử trùng thường mọc thêm hai chồi non.
Để cung cấp đủ mẫu cấy cho thí nghiệm về môi trường, phôi được tách ra khỏi hạt và được nuôi cấy, các đỉnh cây con sau đó được sử dụng. Các mẫu cấy lấy từ các cây được trồng bên ngoài sau đó được trồng trên các nghiệm thức thành công nhất.
Các nồng độ muối khoáng khác nhau được kiểm tra bao gồm môi trường Murashige và Skoog (MS), môi trường Woody Plant (WPM), môi trường Rao 'X' (X) và Gamborg B5 (B5), trong đó môi trường 1/2 MS và B5 được phát hiện là phù hợp nhất. Đối với nhân giống, các mẫu thân có đáp ứng tốt nhất trong môi trường chứa 1/2 MS đa lượng+ MS vi lượng + 2 mgL -1 Glycine + 1 mgL -1Thiamine + 400 mgL -1Inositol + 0,5 mgL -1 Nicotinicacid + 0,5 mgL -1 Pyridoxine + hỗn hợp 3 mgL -1 BAP, 1 mgL -1Zeatin, IBC 0,25 mgL -1 và 1 mgL -1 GA3. Gelcarin thay thế phytogel là nhân tố làm đông giúp giảm hiện tượng thủy tinh hóa (hyperhydricity). Gel mềm dường như cũng làm mềm và hoại tử thân. Sự tạo rễ thành công đã được tạo ra trong môi trường trên bằng cách sử dụng cả 1 mgL -1 IBA hoặc 1mgL -1 NAA. Các thử nghiệm trồng cây hiện đang được tiến hành.
Giới thiệu:
Rừng ngập mặn là đặc điểm của vùng bãi triều bờ biển nhiệt đới và cận nhiệt đới. Chúng đã phát triển một số đặc điểm hình thái và sinh lý độc đáo để thích ứng với môi trường sống luôn thay đổi với muối và bùn vì chúng đóng một vai trò quan trọng trong việc bảo vệ bờ biển và duy trì chất lượng nước cũng như đa dạng sinh học. Rừng ngập mặn có ý nghĩa quan trọng về mặt kinh tế, sinh thái và xã hội nhưng chúng thường xuyên bị đe doạ từ việc phát triển vùng biển, khai thác gỗ quá mức, hoạt động nuôi cá, chuyển nước ngọt và khai thác khoáng sản.
Mặc dù có nhiều hơn sự quan tâm đến các chương trình trồng rừng ngập mặn, nhưng khó khăn là đảm bảo nguồn cung cấp các giống cây được lựa chọn để làm tăng số lượng và quy mô cây trồng. Rừng ngập mặn đang gặp vấn đề đặc thù về hạt do điều kiện môi trường sống và khả năng nảy mầm của hạt chỉ trong những khoảng thời gian ngắn mỗi năm, và việc bảo quản hạt giống do tuổi thọ ngắn và hầu hết các hạt đều lớn. Khả năng sống sót của cây con cũng rất kém do tính chất của môi trường sống của chúng, vì vậy việc trồng cây thay thế thường phải được thực hiện trong ba năm (Saenger và Siddiqi, 1993).
Đến nay, có rất ít các nghiên cứu nuôi cấy mô được thực hiện trên cây ngập mặn. Nghiên cứu hạn chế trên Bruguiera gymnorhiia (Satuwong và đồng nghiệp, 1995) đã được tiến hành bằng cách sử dụng trụ dưới lá mầm làm mẫu cấy trên môi trường MS và WPM có bổ sung 2,4-D và Kinetin, tạo ra mô sẹo trên khoảng 6% mẫu. Sự hình thành chồi đa và một số rễ xảy ra trên môi trường không đường với IBA và phloroglucinol khi chúng được giữ trong bóng tối. Tuy nhiên, không có sự phát triển thêm nào được cảm ứng nữa. Baba và Onizuka (1997) đã cố gắng cải tiến quy trình tái biệt hóa từ mô sẹo của Bruguiera gymnorhiza, Kandelia candel, Pemphis acidula và Rhizophora stylosa nhưng không thành công. Akatsu và cộng sự (1996) có thể duy trì mô sẹo của Sonneratia alba trên môi trường MS bổ sung với một dãy các hoocmôn và sucrose 3% nhưng không có nghiên cứu nào được báo cáo thêm. Tại hội thảo quốc tế về Sinh học và Sinh thái Rừng ngập mặn ở Kuwait năm 1998, Sudhersan và cộng sự (1998) sử dụng phôi của Avicennia marina để phát triển thành cây con trên môi trường MS hoặc cảm ứng thành mô sẹo khi sử dụng hoocmôn tăng trưởng để tạo ra nhiều mô phân sinh sau 3 tháng nhưng không có thông tin chi tiết. Cũng trong sự kiện này, Rao (và sộng sự 1998a) báo cáo sự phát triển của kỹ thuật vi nhân giống cây Exoecaria agallocha, Avicennia marina và Acanthus ilicifolius bằng cách sử dụng các chất đa lượng mới kết hợp với vi lượng và vitamin của môi trường MS. Những chi tiết cụ thể về việc nhân giống Exoecaria agallocha cũng sớm được công bố (Rao và cộng sự, 1998b). Sử dụng thân, chồi nách được cảm ứng trên môi trường 'X' có bổ sung BAP (13,3 uM), Zeatin (4,65 uM) và IBA (1,23 uM). Sự hình thành rễ được cảm ứng trên môi trường 'X' có bổ sung IBA (0.23 uM) và tạo ra cây mới thành công. Eganathan và Rao (2001) đã công bố các quy trình cho ba loài cây ngập mặn bao gồm Avicennia officinalis cũng được nhân được trong môi trường 'X' được bổ sung 1 mgL -1 BAP và 0,5 mgL -1 IBA.
Tại Đại học Cenychal Queensland (Mills và cộng sự, 1999), các kỹ thuật khử trùng tám loài cây ngập mặn đã được tiến hành nhưng thành công đạt được còn hạn chế. Việc làm sạch mẫu Avicennia marina không được tiến hành cho đến khi HgCl2 được sử dụng làm chất khử trùng (P. Bhatia, 2000).
Vi nhân giống là công nghệ có ích và được sử dụng rộng rãi nhất trong các chương trình cải thiện cây trồng. Sharp (1980) kết luận rằng vi nhân giống có thể hữu ích cho các cây rừng ngập mặn có đặc điểm phổ biến như hạt giống xấu, tạo hạt không đều đặn, hạt giống dễ bị tổn thương về di truyền hoặc bị hư trong quá trình bảo quản (Saenger, 1982). Do đó, việc nhân giống in vitro cây ngập mặn thành công sẽ không chỉ cung cấp vật liệu trồng phong phú cho các dự án phục hồi mà còn là nguồn nguyên liệu cho các thử nghiệm nguồn dinh dưỡng, một phương pháp bảo quản giống, trao đổi nguồn gen và công nghệ thiết yếu cho các mục tiêu dài hạn của sự biến đổi bộ gen như kháng mặn, kháng sương hoặc kháng côn trùng (Kamosky, 1981, Maity, 1994).
Công việc này đang được tiến hành cùng với một dự án rộng hơn về "Đa dạng di truyền và Tuyên truyền Rừng ngập mặn" được tài trợ bởi ACIAR phối hợp với Phòng Nghiên cứu Lâm sinh, Cục Lâm nghiệp, Bangkok, Thái Lan và Phòng Nghiên cứu Hệ sinh thái Rừng ngập mặn, Đại học Quốc gia Việt Nam, Hà Nội, Việt Nam.
Công việc ban đầu được thực hiện trên cây ngập mặn phổ biến, cây mấm ổi Avicennia marina. Mục tiêu bao gồm đánh giá mức độ biến đổi di truyền trong và giữa các quần thể rừng ngập mặn, mức độ các đặc điểm mong muốn được xác định về mặt di truyền và sự phát triển các quy trình sàng lọc và chọn lọc để xác định các kiểu gen mong muốn cũng như kỹ thuật nhân giống.
Vật liệu và phương pháp
Vật liệu thực vật
Các mẫu cấy được lựa chọn từ chồi đỉnh và chồi nách của cây con Avicennia marina 2 đến 3 năm tuổi và cây trưởng thành. Nhân giống từ cây trưởng thành là cần thiết nếu một số đặc tính hình thái được quan sát có ích về sau. Tuy nhiên nguồn mẫu cấy này rất khó để nuôi vì mức độ ô nhiễm của môi trường rừng ngập mặn cao, do đó cây giống được trồng trong điều kiện nhà kính cũng được sử dụng như một nguồn vật liệu để làm mẫu cấy.
Do hạt được khử trùng dễ dàng hơn nên chúng được phân cắt và nuôi cấy để cung cấp nguồn đỉnh sinh trưởng vô trùng cho các thử nghiệm môi trường.
Khử trùng và bắt đầu nuôi cấy hạt Avicennia marina
Những hạt mới (> 2cm) vẫn còn cuống thu được từ cây trưởng thành, loại bỏ những hạt bị ruồi giấm Euphranta marina tấn công (P. Mackay, 2000). Hạt giống được khử trùng trong 10 phút với natri hypochlorite 10% (NaOCl) trong dung dịch Tween 20. Sau đó, những chồi mầm chưa trưởng thành với lá mầm đơn được phân cắt và nuôi trên môi trường đơn giản là 1/2 MS (Murashige và Skoog, 1962) đa lượng, MS vi lượng, MS vitamin, 1 mLL -1 hỗn hợp chất bảo quản thực vật (PPM), 30gL-1 sucrose và 2gL-1 phytogel.
Khử trùng và bắt đầu nuôi cấy Avicennia marina bằng cơ quan sinh dưỡng
Việc khử trùng các mẫu cấy lấy từ những cây được trồng trong nhà kính hoặc trồng bên ngoài tự nhiên thì khó hơn nhiều. Các đỉnh sinh trưởng được thu thập và sau đó được khử trừng bằng nhiều biện pháp vật lý và hóa học khác nhau. Các phương pháp vật lý bao gồm: cắt tỉa, chà xát nhẹ bằng xà bông diệt khuẩn, khuấy trong dung dịch 2% Tween 20, ngâm trong 70% Ethanol (EtOH) và rửa dưới vòi nước. Các hóa chất khử trùng được sử dụng với nồng độ và thời gian tiếp xúc khác nhau, bao gồm NaOCl, calcium hypochlorite (CaOCl), thủy ngân Chloride (HgCl2), Nitrat bạc (AgN03), Benzalkonium Clorua và Dầu Trà. Sau khi rửa nhiều lần trong nước không chứa ion (deionised water) vô trùng, tất cả các mẫu cấy được nuôi trên môi trường đơn giản gồm 1/2 MS đa lượng, MS vi lượng, MS vitamin, 2 mgL-1 glycine, 30 gL-1 sucrose và 2 gL-1 phytogel.
Xác định môi trường
Để xác định môi trường phù hợp nhất cho nhân giống Avicennia marina, những muối cơ bản trong các môi trường phổ biến đã được công bố trước đó được dùng để kiểm tra ban đầu, bằng cách sử dụng các đỉnh sinh trưởng có cùng chiều dài từ cây con trong nuôi cấy. Kết quả từ nguồn mẫu cấy này có thể không trực tiếp áp dụng cho các đốt cây trưởng thành nhưng cung cấp một điểm khởi đầu (de Fossard, 1993). Kể từ khi động lực chính cho nghiên cứu vi nhân giống này là sản xuất thương mại, phản ứng của các mẫu cấy với các môi trường thí nghiệm đã được ghi nhận chứ không phải đo chính xác để hỗ trợ cho việc sàng lọc nhanh hơn các lựa chọn và sử dụng các chất như là bước đệm cho thí nghiệm tiếp theo (de Possard, 2000 ).
Tất cả các môi trường thử nghiệm được chia làm 10 thí nghiệm, mỗi thí nghiệm chứa 1 mẫu cấy đơn. Môi trường được điều chỉnh đến pH 5,7 trước khi cho 10 ml vào các ống nghiệm polycarbonate 30 mL và hấp ở 121 ° C và 1,05 kg cm-2 trong 20 phút. Các thí nghiệm được đặt trong phòng sáng (phòng nuôi cấy) duy trì ở nhiệt độ 25 ° C ± 2 ° C trên kệ lưới với chu kỳ quang từ đèn huỳnh quang trên mỗi kệ là 16 giờ sáng / 8 giờ tối (NEC Standard Daylight High-Grade và NEC Biolux ) với cường độ ánh sáng 35 umol m-2s-1.
Đối với tất cả các thí nghiệm, 10 đỉnh sinh trưởng được nuôi trong mỗi môi trường và sự tăng trưởng được ghi nhận sau 30 ngày theo thang từ 0 đến 5, 0=không có thay đổi, 1 = tăng trưởng thân <1 mm, 2 = Tăng trưởng thân 1-10 mm, 3 = tăng trưởng thân 10-20 mm, 4 = tăng trưởng thân 20-30 mm, và 5 = tăng trưởng thân 30-40 mm. Sai số do nhiễm khuẩn hoặc điều kiện nuôi cấy mất cân bằng sẽ được loại bỏ khỏi dữ liệu. Nếu có thể, một thử nghiệm cũng sẽ được lặp lại và ghi nhận một lần nữa sau 30 ngày nếu số lượng mẫu cấy đủ.
Thí nghiệm 1: Thử nghiệm ban đầu được so sánh với 4 nồng độ (1/4, 1/5, 3/4 và 1) của môi trường MS + 20gL-1 sucrose, 2gL -1 phytogel và pH được điều chỉnh đến 5,7. Môi trường ½ MS là môi trường thành công nhất mà sau đó đã được thử nghiệm với ba môi trường đã được công bố khác là môi trường Woody Plant (WPM) do McCowan và cộng sự (1981) đặt tên, môi trường 'X' (Rao và cộng sự, 1998b) và B5 (Gamborg và cộng sự, 1968). Xem bảng 1 để biết thành phần các môi trường.
Thí nghiệm 2: Môi trường 1/2 MS được bổ sung thêm các nồng độ khác nhau của 6-benzylaminopurine (BOT) và Kinetin (0.1, 1.0, 5.0, 10.0 mgL-1), hai cytokinin được sử dụng phổ biến cho cây gỗ này được thử nghiệm riêng lẻ và kết hợp .
Thí nghiệm 3: BAP và Kinetin lần lượt thử nghiệm với axit Naphthaleneacetic (NAA) trong môi trường 1/2 MS cơ bản.
Thử nghiệm 4: 1 tổ hợp của 3 PGRs (3 mgL -1 BAP + 1 mgL-1 Zeatin + 0.25 mgL-1 Indolebutyric acid (IBA)) đã sử dụng thành công với cây E. agallocha (Rao và cộng sự, 1998b) được thử nghiệm với ba môi trường muối cơ bản (1/2 MS, B5 và modified 'X'). Một thử nghiệm với việc loại bỏ Zeatin cũng được tiến hành do chi phí của cytokinin này (một sự cân nhắc quan trọng trong sản phẩm thương mại).
Thí nghiệm 5: Vì mẫu cấy của A. marina chậm đáp ứng trong nuôi cấy, nên hai nghiệm thức đã được thử nghiệm. Các thí nghiệm sử dụng môi trường 1/2 MS có bổ sung 6.675 uM thidiazole (TDZ, chứa trong 3 mgL -1 của Dropp, một chất làm rụng lá cây bông thương mại) hoặc 1 mgL-1 GA3 trong 10 ngày trước khi chuyển sang bước nuôi cấy tiếp theo.
Thử nghiệm 6: Nước dừa với các nồng độ khác nhau (50.150, 400 mLL-1) được thêm vào môi trường 1/2 MS + 3 PGRs + 20gL -1 sucrose. Thí nghiệm này được lặp lại ở Hà Nội nhưng có sự khác biệt đáng kể về chất lượng nước dừa do chất lượng dừa địa phương có sẵn ở thời điểm đó.
Thí nghiệm 7: Lượng Sucrose tăng từ 20 gL -1 đến 30 gL-1 trong môi trường 1/2 MS + 3 PGRs. Dãy nồng độ lớn hơn của sucrose không thể thiết lập vào thời điểm này do thiếu số lượng mẫu cấy vô trùng.
Thử nghiệm 8: Thí nghiệm về liều lượng của Inositol (100, 200, 400 mgL-1) trên muối cơ bản 1/2 MS và B5 + 3 PGRs (S. Rao, 2001).
Thí nghiệm 9: Thí nghiệm về liều lượng của GA3 và không có GA3 (0,05, 1,0,2,0 mgL-1) trên 1/2 MS + 3 PGRs.
Thử nghiệm 10: Thử nghiệm Giai đoạn III của hai auxins, NAA (0.5,1.0 mgL -1) và IAA (0.5.1.0 mgL-1) trên cả 2 môi trường cơ bản 0.5 MS và B5.
Kết quả và thảo luận
Giai đoạn I
Việc khử trùng Avicennia marina thành công hay không phụ thuộc vào thời gian của năm, nguồn vật liệu thực vật và mẫu cấy (đỉnh sinh trưởng, đốt thân thứ nhất và thứ 2). Mẫu cấy lấy từ cây con 1 đến 2 năm tuổi thành công hơn so với cây trưởng thành có thể là do chúng tiết phenol ít hơn. Môi trường xung quanh mẫu cấy hóa đen gây hoại tử mô, có thể được khắc phục bằng việc thay thế môi trường thường xuyên hoặc thêm polyvinylpyrrolidone (PVP) hoặc PPM vào môi trường (Gurit, 1997). Trong trường hợp này, PPM có hiệu quả tốt nhất. Các mẫu cấy thu từ nhà kính thành công hơn so với khi thu từ thực địa và sự nhiễm nấm có thể được giảm bớt nếu Benlate (0.5 gL-1) được phun trên cây vài ngày trước khi lấy mẫu. Các đốt thân là những phần có khả năng đáp ứng nhanh nhất, thường xuyên tạo ra hai hoặc ba chồi, nhưng chúng cũng rất khó làm sạch.
Giai đoạn làm sạch cuối cùng bao gồm cắt tỉa vật liệu thừa từ phần thân trước khi chà xát nhẹ bằng xà bông diệt khuẩn hoặc khuấy trong dung dịch Tvveen 20 2% trong 5 phút. sau đó chúng được rửa dưới vòi nước trong 1 giờ và được cắt tỉa thêm trước khi khuấy trong dung dịch HgCl2 0,1% trong 5 đến 20 phút. Vật liệu thực vật sau đó được rửa lại 5 lần bằng nước cất vô trùng trước khi chúng được cắt ra thành chồi đỉnh hoặc chồi thân. Việc thêm PPM vào môi trường làm giảm tỷ lệ nhiễm, nhưng khi không còn được thêm vào, vi khuẩn lại xuất hiện. Cần thêm các thử nghiệm để xác định nguồn gốc của các vi khuẩn thường xuyên xuất hiện do chúng có thể có nguồn gốc nội sinh.
Giai đoạn II
Quyết định 'kiểu' nhân giống mong muốn cho A. marina đã tính đến những khó khăn mà nó phải đối mặt với sự thay đổi môi trường sống. Do đó phát triển chồi thành cây con với sự kéo dài bình thường hoặc lớn hơn của thân cây, để mỗi đốt có thể được cắt bỏ và tái nuôi cấy, được lựa chọn thay vì vượt qua ưu thế đỉnh bằng phương pháp hóa học để phát triển nhiều chồi. Mỗi thí nghiệm dựa trên kết quả của các nghiên cứu trước đó, tuy nhiên việc mở rộng thí nghiệm bị giới hạn do thiếu vật liệu thực vật. Tốc độ tăng trưởng chậm nhưng điều này có thể được cho là do việc sử dụng các chồi đỉnh chứ không phải là những mấu thân từ những cây được nuôi cấy, vật liệu duy nhất có sẵn trong số lượng được yêu cầu.
Thí nghiệm 1
Tần số trung bình cho mỗi loại tăng trưởng thân cây, đại diện cho các cây con sống sót từ mỗi lần thử nghiệm trong tổng số 10 cây được trình bày trong hình 1. Các thử nghiệm được lặp lại khi các môi trường muối cơ bản khác nhau được thêm vào sau đó. Ban đầu, môi trường phù hợp nhất là 1/2 MS đa lượng + MS vi lượng + MS vitamin + 20 gL -1 sucrose, môi trường này được sử dụng cho các thử nghiệm về các chất điều hòa tăng trưởng thực vật khác nhau. Sau đó, môi trường B5 kết hợp với MS (sắt + EDTA) + Vitamin B5 cũng được phát hiện là môi trường phù hợp, môi trường 'X' (Rao, 2000) không phù hợp đối với A. marina ở bất kỳ giai đoạn nào.
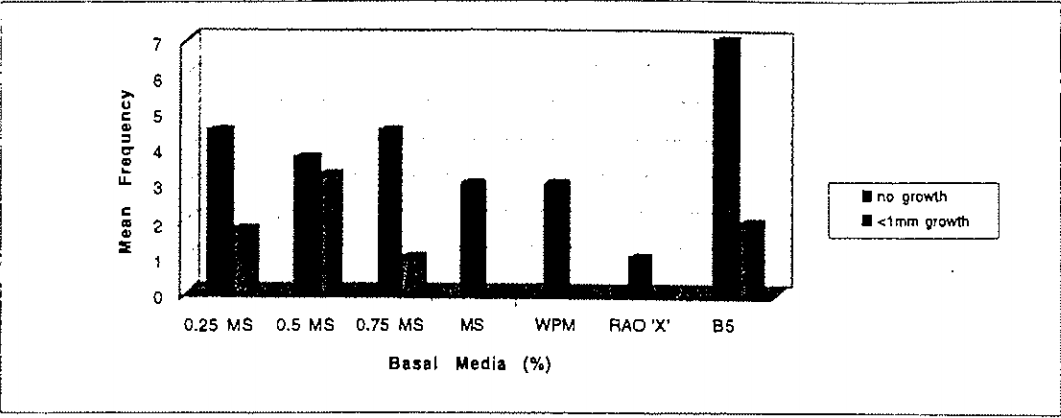
Hình 1: Đáp ứng tăng trưởng của A. marina trên các nồng độ khác nhau của môi trường Murashige và Skoog (MS), môi trường Woody Plant (WPM), môi trường 'X' và B5
Thí nghiệm 2
Vật liệu thực vật đáp ứng tốt nhất với hỗn hợp của BAP và Kinetin (Hình 2).
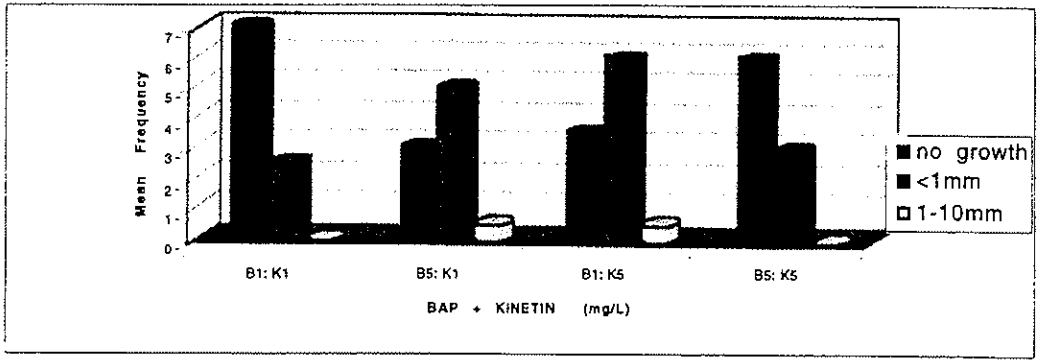
Hình 2: Đáp ứng tăng trưởng của A. marina trên môi trường ½ MS + hỗn hợp BAP (B) 1 và 5 mgL-1 + Kinetin (K) 1 và 5 mgL-1
Thí nghiệm 3
Tỷ lệ sống sót và phát triển cao hơn trên môi trường được bổ sung BAP và NAA (57%) so với môi trường được bổ sung Kinetin và NAA (19%). Khi nồng độ của auxin bằng hoặc cao hơn nồng độ cytokinin, rễ phát triển mạnh, chứng tỏ sự tạo rễ có thể không quá khó ở A. marina. Tuy nhiên, mẫu cấy không được tiếp xúc với môi trường nhân lên có thể ảnh hưởng đến sự phát triển rễ.
Thí nghiệm 4
Tổ hợp của các PGRs được lựa chọn trong báo cáo của Rao (1998b). Zeatin không thường xuyên có hiệu quả với các loài thân gỗ được thay thế bởi Kinetin và IBA được thay thế bởi NAA. Đỉnh chồi đáp ứng thuận lợi trên cả 2 môi trường ½ MS và B5 nhưng chúng bị chết trên môi trường B5 (Hình 3).
Số lượng lá đáng kể bị xoắn khi nồng độ cytokinin cao dẫn đến những thử nghiệm với nồng độ cytokinin được giảm xuống bởi vì nồng độ cytokinin cao khiến chồi nhỏ và không đủ khả năng để kéo dài, hình thái lá khác thường và khó ra rễ (George, 1996). Kết quả của giai đoạn này không được xác định.
Hình 3: Đáp ứng tăng trưởng của A. marina trên 3 môi trường môi trường muối cơ bản (‘X’, B5 và ½ MS) có bổ sung 3 PGRs (3 mgL-1 BAP + 1 mgL-1 Zeatin + 0.5 mgL-1 IBA)
Thí nghiệm 5
Các mẫu cấy tiếp xúc với Dropp trong 10 ngày bị vàng và chết nhưng chúng phát triển khi tiếp xúc với GA3. Phản ứng chậm của mẫu cây có thể là do giai đoạn ổn định, nhưng với số lượng vật liệu thực vật hạn chế, giai đoạn này bị ngưng và thí nghiệm phản ứng liều lượng của GA3 đã được thiết kế.
Thí nghiệm 6
Các chất chưa được xác định như nước dừa thường không được sử dụng vì tính chất hoá học của chúng không được biết chính xác. Tuy nhiên, nước dừa là nguồn cung cấp nhiều chất dinh dưỡng bao gồm Zeatin, GA3, inositol và đường. Nghiên cứu này cũng đang được tiến hành tại Việt Nam với kết quả mong muốn là sản xuất hàng loạt nước dừa giúp cung cấp nguồn dinh dưỡng sẵn có và rẻ tiền.
A. marina đáp ứng tốt với việc bổ sung nước dừa với sự phát triển của chồi nách trong vòng 30 ngày với 16% cây được nuôi trên môi trường 1/2 MS không có bổ sung PGR (hình 4). Sự gia tăng hình thái bất thường của lá (cong) trên môi trường bổ sung 400 mL nước dừa và 3 PGRs (Hình 5) có thể cho thấy rằng tổng mức cytokinin quá cao. Thí nghiệm này được lặp lại tại Việt Nam nhưng số liệu không được so sánh do sự khác nhau của nước dừa và vật liệu thực vật.
Hình 4: Đáp ứng tăng trưởng của A. marina trên môi trường ½ MS có bổ sung nước dừa (150 hoặc 400 mLL-1 )
Hình 5: Đáp ứng tăng trưởng của A. marina khi bổ sung các nồng độ khác nhau của nước dừa vô môi trường 1/2 MS + 3 PGRs (3 mgL-1 BAP +1 mgL-1 Zeatin + 0.5 mgL-1 IBA)
Thí nghiệm 7
Mặc dù không phải là một thí nghiệm rộng rãi, và tỷ lệ tăng trưởng không khác biệt rõ rệt giữa hai nồng độ sucrose, cây trồng trông xanh hơn và khỏe mạnh hơn sau 30 ngày trong môi trường chứa 30% sucrose.
Thí nghiệm 8
Mặc dù inositol là một thành viên của phức hợp vitamin B, nhiều người tin rằng, trong vi nhân giống, nên coi nó như là một chất bổ sung carbohydrate và nó có thể giúp cho sự hình thành chồi và làm chậm quá trình hoại tử (George, 1993). Nó cũng được coi là một phần của nước dừa (Pollard và cộng sự, 1961). Inositol hiếm khi được coi như là một phần quan trọng trong nuôi cấy mô nhưng nó được thử nghiệm ở đây theo nghiên cứu của Rao (2000). Kết quả cho thấy tăng inositol từ 100 mgL -1 đến 400 mgL-1 cải thiện đáp ứng tăng trưởng của chồi nách, do đó tạo ra 2 hoặc 3 chồi thay vì 1 từ mỗi đốt thân. Phản ứng này trên môi trường B5 (33%) tốt hơn so với môi trường 1 / 2 MS (18%).
Thí nghiệm 9
Bổ sung GA3 vào môi trường 1/2 MS + 3 PGR cải thiện sự tăng trưởng và kích thích chồi nách phát triển tốt hơn (18%). Tuy nhiên, hình thái bất thường ở lá (uốn cong) vẫn xảy ra. Việc nuôi cấy thêm được thực hiện thành công bằng cách sử dụng các phần thân từ chồi chính và các nhánh nách trên môi trường 1/2 MS + 1 mgL -1 GA3 + 3 PGRs + 30gL sucrose.
Hình 6: Đáp ứng tăng trưởng của A. marina trên các nồng độ khác nhau của GA3 với 1/2 MS + 3PGRs (3 mgL-1 BAP + 1 mgL-1 Zeatin + 0.5 mgL-1 IBA)
Thí nghiệm 10
Sự tạo rễ đã đạt được một cách dễ dàng bằng NAA trong thí nghiệm 3 nhưng khó khăn hơn sau khi cây bị tiếp xúc với môi trường nhân giống. Các rễ đã xảy ra ở 50% số mẫu thu được từ thực địa nuôi cấy trên môi trường 1/2 MS và B5 bổ sung với IBA hoặc NAA (0.1 và 1.0 mgL-1) sau 30 ngày. Việc nuôi cấy sau đó không cải thiện kết quả thí nghiệm. Cần phải kiểm tra thêm môi trường không hoocmone hoặc bổ sung than hoạt tính để loại bỏ vết tích của GA3 (có thể ức chế sự hình thành của rễ) nhưng các vật liệu thực vật thu được từ giai đoạn II còn hạn chế.
Nghiên cứu ở đây chứng minh rằng các mẫu cấy từ Avicennia marina đã được thực hiện thành công ở các giai đoạn như in vitro (Giai đoạn I), nhân lên (Giai đoạn II), phát triển rễ (Giai đoạn III) và chuyển ra chậu (Giai đoạn IV) nhưng tất cả đều thành công ở mức độ khác nhau. Ở giai đoạn này, môi trường thành công nhất là môi trường muối cơ bản Gamborgs B5 hoặc 1/2 MS đa lượng + MS vi lượng được bổ sung 2 mgL -1 Glycine + 1 mgL -1 Thiamine + 400 mgL-1 Inositol + 0,5 mgL-1 Nicotinic acid + 0,5 mgl-1 pyridoxin + 3 mgL -1BAP, 1 mgL -1 Zeatin, 0,25 mgL-1 IBA và 1 mgL -1 GA3 + 30gL-1 sucrose + 7gL -1 Gelcarin. Tốc độ tăng trưởng vẫn chậm nhưng có thể được cải thiện với các chất bổ sung thêm trong môi trường tiếp theo. Nếu có thể, vật liệu có nguồn gốc từ thực địa được nuôi tiếp trên môi trường này, kích thích thêm sự phát triển.Tại giai đoạn này của thí nghiệm, chỉ có một lượng mẫu hạn chế được tiến hành tạo rễ trong nuôi cấy và trồng thử nghiệm.
Cần tiếp tục nghiên cứu về nuôi cấy mô của Avicennia marina để có thể tối ưu hóa các nhân tố vật lý và hóa học. Việc bổ sung natri clorua (NaCl) vào môi trường đã được ngăn chặn cho đến nay bởi vì thông thường người ta hiểu lầm tầm quan trọng của muối và thực vật rừng ngập mặn đang phát triển chậm và không thể cạnh tranh được với các loài sinh vật phát triển trừ khi muối được loại bỏ khỏi môi trường (Hutchings và Saenger 1987). Tuy nhiên, trong các thử nghiệm in vitro, Tuan và cộng sự (1996) cho biết rằng muối là một yếu tố quan trọng đối với sự phát triển cây con Avicennia marina. Tỷ lệ nảy mầm và tốc độ sinh trưởng tăng với độ mặn thấp hơn, nồng độ tối ưu là 25% trong nước, nhưng cũng không có nghĩa là hạt giống khỏe mạnh ở tất cả các độ mặn, Do đó, các nghiên cứu hiện nay bao gồm các thí nghiệm về natri clorua NaCl. Các nghiên cứu trong tương lai bao gồm các thử nghiệm thêm với nước dừa, vì đây là môi trường tốt nhất ở Hà Nội và làm giảm nồng độ và / hoặc sự kết hợp của cytokinin trong giai đoạn II có thể làm giảm các lá có hình thái bất thường và tăng tỷ lệ nhân giống.
Lời cảm ơn
Chúng tôi muốn cảm ơn đế sự sự hỗ trợ tài chính của ACIAR
Tài liệu tham khảo
Akatsu, M.Y., Hosoi, Y., Sasamoto, H. and Ashirara, H, 1996, Purine metabolism in cells of a mangrove pỉant. Sonneratia alba in tissue culture. Pìant Physioìogy 149: 133-137.
Baba, s. and Onizuka, R.I. 1997. Callus induction of fìve mangrove ưee species. p. 339-347 In: Kjerfve B. L. D. Lacerda and s. Diop (eds.) Mangrove Ecosystem Studies in Latin Ainerìca and Aírica. U.N.E.S.C.O. Paris.
de Possard, R.A. 20CK). Commercial Micropropagation, Xarma Pty. Ltd. Eagle Heìghts, Qld, Austraỉia.
de Possard, R.A. 1993. Plant Tissue Culture Propagation. Xanna Pty Ltd Eagle Heights, Qld. Australia,
Eganathan, p. and Rao, c.s. 2001. Manual on Vegetative and Micropropagation of Mangroves. M.s. Swaminathan Research Foundation Chennai, India.
Gamborg, O.L., Miỉler, R.A., Ojima, K. 1968. Nutrient requìrements of suspension cuitures of soybean root celis. Experimentaỉ Cell Research 50: 151-158.
George, E.F.1993. Pìant Propagation by Tissue Culture. Part 1: The Technology. Exegetics Ltd., U.K.
Guri, A. 1997 Advances in controiling pỉant tissue cuỉture contamination using the new biocide PPM. Plant Cell Technology, Inc. Washington, D.c.
Hutchings, p. and Saenger. p. 1987. Ecology of mangroves. Ưniversity of Queensaind, Press, Ausữaỉia.
Karnosky, D.F. 1981. Potentìal for ĩorest ưee improvement vịa tissue culture. BioScience 31: 114-120.
Maíty.s. 1994 Biotechnoỉogy in conservation of mangroves - a case study. Proceedings of national symposium on conservation and management of living resourses, Bangalore, India, 1990 pp 1-10.
McCown, B.H. and Lloyd, G.B. 1981. Woody plant mediurn (WPM) “ a mineral nutrient íormulation for microculture of woody plant species. Horticulture Science 16, 453 (abst.394).
Mills, J. and Ashwath, N. 1999. Technìques of disinfesting mangroves for tissue culture. Central Queensiand University, Rockhampton.
Murashige, T and Skoog, P1962. Arevised medium for rapìd growth and bioassays with tobacco tissue cuỉtures. Physiologia Plantarum.15: 473-497.
Pollard, I.K., Shantze E.M. and Steward F.c. 1961. Hexitols in coconut milk: their role in the nuture of đivĩding cells. Piant Physiolgy 36: 492-501.
Rao, C.S., Eganathan, p., Anand, A., Rangan, L. and Balakrishna, p. 1998a. Application of biotechnology and classical breeding methods in the genetic enhancement 0f mangroves. Abstract Proceedings International Symposium on Mangrove Ecology & Biology, Kuwait.
Rao, C.S., Eganathan, R, Anand, A., Balakrishna, p. and Reddy, T.p. 1998b. Protocol for in viừo propagation 0f Excoecaria agaỉỉocha L., a medicinaỉly ỉmportant mangrove species. Pianí Celì Reports 17: 861- 865.
Saenger, p. 1982 Morphological, anatomical and reproducíive ađaptations of Ausưalian mangroves. ĩn: Mangroveecosystems in Ausưalia (Ed. B.F. Clough), Australian National University Press, Canberra, Ausưalia, pp. 153-191.
Saenger, p. and Siddiqi, N.A. 1993. Land from the Sea; the mangrove afforestation program of Bangladesh. Ocean and Coastal Management. 20: 23-39.
Sharp, W.R. 1980. Overview of potentiaì in agdcultural application. In Vìtro 16: 221.
Satuwong, I, Ninomiya, I. andOgino, K. 1995. Callus and multiple shootíormation in Bruguỉeragymnorrhỉza. Bulỉ. Ehime ưniv. Forest. 32: 25-33.
Sudhersan, c., Abo-ElNil, M. and Al-Ajeel, A. 1998. ỉn vỉtro tissue culture and differentiation of Avỉcennia marina. Abstract Proceedings of International Symposium. on Mangrove Ecology and Biology, Kuwait, 1998.
Tuan, M., Ninomiya, I. and Ogino, K. 1996 Effect of different levels of extemal saỉinity on germination, growth and photosynthesis in a mangrove, Avicennia marỉna. Tropics .6(1/2): 39-50.
Bảng 1: Thành phần các môi trường dùng trong thí nghiệm.
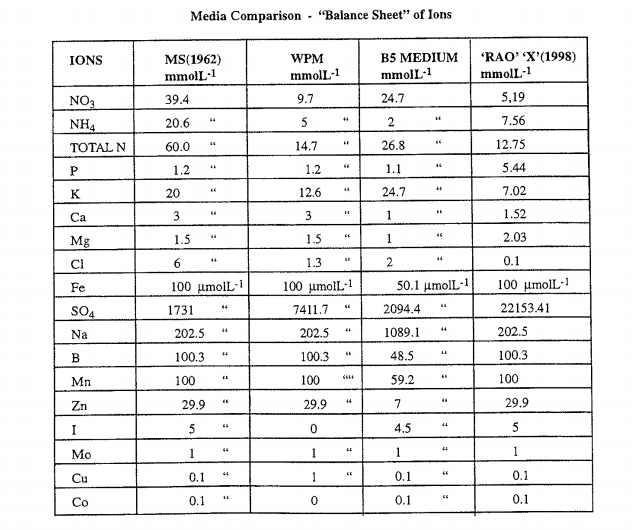
MS: Murashige and Skoog medium (1962)
WPM: Woody Plant Medium (McCowan & Lloyd - 1981)
B5: Gamborg's Medium( 1968)
RAO 'X" : Medium for
Excoecarria agallocha (1998b)
Hoài Bảo
SBC Scientific