VI NHÂN GIỐNG TỪ CÂY CON VÀ CÂY TRƯỞNG THÀNH CỦA MÃNG CẦU XIÊM Annona muricata L.
Bởi E. E. P. LEMOS1 và JENNET BLAKE2
1Universidade Federal de Alagoas, Dep. Agronomia, Cid. Universitaria, BR 104 Norte km 14, Maceio, AL, Brazil CEP 57072-970
2Unit for Advanced Propagation Systems, Department of Horticulture, Wye College, University of London, Wye, Ashford, Kent TN25 5AH, UK
Tóm tắt
Một quy trình nhân giống hoàn chỉnh sử dụng các cây con hoặc cây trưởng thành của mãng cầu xiêm (Annona muricata L.), một loài cây ăn quả nhiệt đới, đã được phát triển. Chồi bất định và chồi ngọn đã được tạo ra từ phần trụ dưới lá mầm. Các chồi bên đã được tạo ra từ các mô phân sinh ban đầu trong các mắt ngủ của mẫu vật từ cây trưởng thành. Sự gia tăng nồng độ BAP thêm vào môi trường Woody Plant đã kích thích lên đến bốn hoặc năm chồi trên mỗi mẫu vật lần lượt ở dạng đoạn chứa mắt ngủ hoặc trụ dưới lá. Việc bổ sung NAA với BAP là điều cần thiết cho sự phát triển của chồi. Rễ được kích thích bởi galactose và NAA sau khi cây con được nuôi 2 tuần trong môi trường đơn giản có than hoạt tính 10 g/L. Các cây con ra rễ đã được cho thích nghi khí hậu thành công.
GIỚI THIỆU
Mãng cầu xiêm (Annona muricata L.) là một loại cây ăn quả nhiệt đới, họ Annonaceae, được cho là có nguồn gốc từ khu vực Amazon, nơi có nhiều giống bản địa (Moraes, 1979). Đây là cây ăn quả nhiệt đới cao 6-8 m, cho giả quả xanh nhạt hình elip phủ đầy gai mềm. Thịt quả giống như bông, mọng nước, có mùi và hương vị đặc trưng. Sự quan tâm của thị trường gần đây đối với các loại trái cây nhiệt đới mọng nước và nhiều thịt quả, cho thấy sự cần thiết phải cải tiến việc canh tác. Tuy nhiên, các công nghệ nhân giống mới vẫn chưa được phát triển cho cây trồng này.
Mặc dù đã có nhiều nghiên cứu nuôi cấy mô về một loạt các loài cây nhiệt đới, nhưng họ Annonaceae rất ít được chú ý và có rất ít thành công được báo cáo (Nair và cộng sự, 1984a, b, Jordan và cộng sự, 1991; Encina và cộng sự, 1994). Mặc dù đã được nhân giống thông qua các kỹ thuật truyền thống (George và Nissen, 1987), nhưng mãng cầu xiêm hầu như không được nghiên cứu in vitro, chỉ có một lưu ý vi nhân giống được xuất bản (Bejoy và Hariharan, 1992). Các tác giả đã sử dụng các trụ dưới lá mầm làm nguồn mẫu vật để phát triển loài cây này và có trung bình 4.8 chồi/ mẫu vật được tạo ra trong xử lý tốt nhất (2 mg/L benzylaminopurine (BAP) và 0.1 mg/L napthalene acetic acid (NAA) trên môi trường MS cơ bản (Murashige and Skoog, 1962) sau khi nuôi 35 ngày. Mặc dù tương đối thành công trong xử lý cho ra rễ, nhưng có tỷ lệ sống sót thấp, chỉ 35%, trong giai đoạn thích nghi khí hậu
Sự phát triển của một phương pháp luận để vi nhân giống A. muricata từ cây trưởng thành sẽ thúc đẩy quá trình sàng lọc và nhân giống cây ưu tú và sẽ tạo điều kiện cho việc trao đổi vật chất giữa các trung tâm nghiên cứu. Nghiên cứu này mô tả những thí nghiệm sử dụng mẫu vật là trụ dưới lá mầm của hạt nảy mầm (vật liệu chưa trưởng thành/vật liệu non) và các đoạn cành mang mắt ngủ từ cây trưởng thành. Những thí nghiệm này đưa ra được một quy trình vi nhân giống có thể được sử dụng trong các nghiên cứu sâu hơn để cải tiến loài này.
VẬT LIỆU VÀ PHƯƠNG PHÁP
Vật liệu chưa trưởng thành/vật liệu non: mẫu vật trụ dưới lá mầm
Hạt của Annona muricata được lấy từ quả chín và rửa bằng nước máy để loại bỏ tất cả thịt còn sót lại, sấy khô và để trong túi giấy đến thời điểm sử dụng. Hạt giống, vẫn còn lớp vỏ ngoài, được khử trùng bề mặt và đặt trên giấy ẩm vô trùng trong hộp Magenta vô trùng trong tủ ủ ở 30°C trong bóng tối. Sự nảy mầm bắt đầu sau 20 ngày và cây con được để trong bóng tối thêm 10 ngày nữa để tạo trụ dưới lá mầm đạt khoảng 12 cm. Các trụ dưới lá mầm vô trùng được cắt ngay dưới cặp lá đầu tiên và ngay phía trên rễ cái và chia thành các phần 15 mm.
Vật liệu cây trưởng thành: Mẫu vật mang mắt ngủ
Các phần thân cây, dài 15 mm, được thu hoạch từ các cây đã trưởng thành 3 năm tuổi đã được trồng trong nhà kính. Mẫu vật được khử trùng với 10% (v/v) chất tẩy 'Brobat' trong nước thẩm thấu ngược vô trùng, tạo ra 0.5% Clo. 'Tween 20' đã được thêm vào ở 0.01% như chất hoạt động bề mặt. Cách xử lý này được theo sau bởi ba lần xả với nước nước thẩm thấu ngược và cắt tỉa lần cuối để loại bỏ mô chết trước khi nuôi cấy.
Môi trường và điều kiện nuôi cấy
Môi trường cơ bản Woody Plant (WPM), được xác định bởi Lloyd and McCown (1980, 1981), bổ sung 20 g/L sucrose có nguồn gốc từ mía và 7 g/L agar (Technical grade 3, Oxoid, Anh) được sử dụng. pH đã được điều chỉnh đến 5.8 trước khi hấp khử trùng. Tất cả các thí nghiệm được thực hiện với cường độ ánh sáng từ 40-50 µmol/m2.s được cung cấp bởi đèn Philips C84 TDL, thời gian chiếu sáng 16 giờ và nhiệt độ 25 ± 2° C. Vật chứa môi trường được bọc bằng màng polypropylene vô trùng và được giữ chặt bằng băng cao su.
Tạo chồi từ trụ dưới lá mầm và mắt ngủ, có sử dụng chất điều hòa sinh trưởng
Các dung dịch BAP ở 0, 0.5, 1, 2 và 4 mg/L và NAA ở 0, 0.1 và 0.5 mg/L (Hóa chất Sigma) đã được thêm vào môi trường trước khi hấp. Sau khi chuyển mẫu vật trụ dưới lá mầm sang môi trường khác khoảng 6 tuần, bổ sung NAA 1 mg/L và acid gibberellic (GA3) 0.1 mg/L cùng với BAP ở nồng độ 2 hoặc 4 mg/L vào môi trường để kéo dài chồi và cải thiện các số lượng chồi từ trụ dưới mầm. Số lượng mầm (bud) và chồi (shoot) được ghi nhận từ số liệu 12 lần lặp lại cho mỗi nghiệm thức cho trụ dưới lá mầm và 15 lần lặp lại cho các mắt ngủ.
Điều kiện vật lý của môi trường
Các đoạn nhỏ khoảng 1.5 cm được cắt theo chiều ngang từ trụ dưới lá mầm hoặc đoạn cành mang mắt ngủ được nuôi trong môi trường bán rắn. Nuôi cấy trong môi trường bán rắn và lỏng trong "bình sữa trẻ em" (đường kính = 7.7 cm x 5 cm cao) với 10 mL môi trường. Nuôi cấy lỏng được đặt trên máy lắc và sau ba tuần được chuyển sang bình lớn hơn (đường kính = 7.7 cm x 7.7 cm cao) với cùng một lượng môi trường như trước. Các mẫu vật được cấy chuyền một lần trong quá trình thí nghiệm và nhiều chồi phát triển từ các mô phân sinh nách lá, số lượng và chiều dài lá và chiều dài của các đốt thân được phát triển trong môi trường nuôi cấy bán rắn và lỏng được ghi lại sau 6 tuần nuôi cấy với 5 lần lặp lại cho mỗi thử nghiệm.
Xử lý ra rễ
Các mẫu vật đưa ra khỏi môi trường chứa BAP được điều hòa trên môi trường WPM thông thường với 3 g/L than hoạt tính trong 15 ngày để cải thiện các phản ứng của rễ từ các mẫu vật. Một thí nghiệm ban đầu với NAA, IBA và IAA cho thấy NAA có khả năng kích thích tốt nhất sự ra rễ ở loài này. Mẫu vật được xử lý với NAA theo một trong ba cách sau: 1) trong suốt thời gian thí nghiệm đặt mẫu vật trong môi trường bán rắn có chứa 4 mg/L NAA, mẫu đối chứng; 2) được đặt trong môi trường lỏng được hỗ trợ bởi các nút polyester "Sorbarod" (tham khảo PPP2-PLL kích thước 20 X 16mm, Baumgartner Papiers UK) có chứa NAA 4 mg/L trong thời gian 5, 15, hoặc 30 ngày; 16 mg/L NAA trong 5 hoặc 15 ngày; hoặc 64 mg/L NAA trong 5 ngày trong bóng tối; hoặc 3) nhúng vào dung dịch NAA có nồng độ 500 hoặc 1000 mg/L trong 1 hoặc 3 phút. Sau khi xử lý chất lỏng, mẫu vật được đặt trong môi trường WPM cơ bản bán rắn. 12 lần lặp lại mỗi nghiệm thức.
Các loại môi trường và nguồn carbon
Một số môi trường đã chuẩn bị sẵn: MS 4.71 g/L, MS 2.35 g/L (Murashige và Skoog, 1962), WPM 2.62 g/L (Lloyd and McCown, 1981) hoặc NN 2.23 g/L (Nitsch và Nitsch, 1956), được cung cấp bởi phòng thí nghiệm Hoàng gia Anh, đã được sử dụng làm nguồn dinh dưỡng và vitamin, kết hợp với sucrose 20 hoặc 30 g/L; hoặc galactoza ở 10 g/L. Tỉ lệ phát sinh rễ và số rễ trung bình được ghi lại sau 4 tuần nuôi cấy. 15 lần lặp lại cho mỗi thử nghiệm.
Làm quen với khí hậu
Cây đã ra rễ được đặt trong chậu có chất khoáng vermiculite, bên trong chậu có một chất dẻo bằng nhựa phủ lớp mao mạch. Cây được chiếu sáng liên tục với ánh sáng huỳnh quang mát (40 µmol/m2.s1) ở nhiệt độ 24 ± 3°C. Khi lá mới xuất hiện, tăng dần thông gió. Cây được bón các dung dịch dinh dưỡng sau ba tuần.
Xử lý thống kê dữ liệu
Thiết kế thí nghiệm theo nhân tố. Phép chuyển đổi arcsin được sử dụng khi các kết quả thực nghiệm được thể hiện dưới dạng dữ liệu tỷ lệ. Các thử nghiệm thống kê liên quan đến việc sử dụng ANOVA hai chiều và sự khác biệt nhỏ nhất giữa các giá trị trung bình được tính toán (P ~ 0.05). Trường hợp thích hợp, sai số chuẩn của giá trị trung bình được trình bày.
KẾT QUẢ
Tạo chồi từ trụ dưới lá mầm và mắt ngủ nhờ sử dụng chất điều hòa sinh tăng trưởng
Một số lượng đáng kể các chồi (tối đa là 19) được tạo ra từ các trụ dưới lá mầm ban đầu khi chúng được nuôi cấy trên 0 hoặc 0.5 mg/L BAP, ở bất cứ nồng độ NAA nào (Hình 1). Sự gia tăng nồng độ BAP đáng kể (P = 0.05) đã dần dần ức chế số lượng chồi sinh ra. Không có ảnh hưởng đáng kể bởi NAA, ngoại trừ ở nồng độ cao nhất (0.5 mg/L) sử dụng mà không có BAP làm giảm đáng kể số chồi (Hình 1). Trung bình có khoảng 10 chồi trên mỗi mẫu vật trong 100% các mẫu vật đã được ghi nhận.
Hình 1. Ảnh hưởng của BAP và NAA lên số lượng mầm (bud) được sinh ra trên các mẫu vật trụ dưới lá mầm sau sáu tuần nuôi cấy, giá trị trung bình của 12 lần lặp lại cho mỗi nghiệm thức. Các thanh dọc thể hiện sai số chuẩn của giá trị trung bình.
Hình 2. Ảnh hưởng của BAP và NAA lên số lượng chồi phát triển trên các mẫu vật trụ dưới lá mầm sau sáu tuần nuôi cấy, giá trị trung bình của 12 lần lặp lại cho mỗi nghiệm thức. Các thanh dọc thể hiện sai số chuẩn của giá trị trung bình.
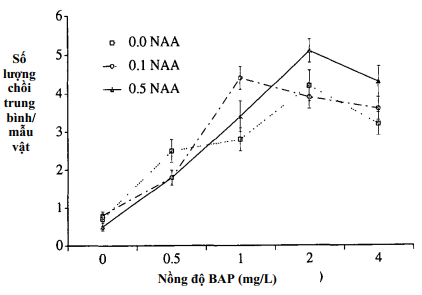
Khả năng chồi được kéo dài và trở thành cây con được mô tả ở Hình 2. Nhìn chung, khi nồng độ BAP thêm vào môi trường tăng một cách đáng kể (P = 0,05) sẽ kích thích số lượng chồi có thể sử dụng được (>= 8mm) lên đến tối đa là 5 chồi cho mỗi mẫu vật. Việc bổ sung NAA thúc đẩy sự kéo dài chồi. Đối với mỗi nồng độ BAP thì có nồng độ tối ưu tương ứng của NAA để tạo ra số lượng chồi nhiều nhất: ở 0.5, 1 và 2 mg/L BAP thì nồng độ NAA tối ưu là 0, 0.1 và 0.5 mg/L. Dường như có một sự cân bằng tối ưu giữa các chất điều hòa sinh trưởng này; tuy nhiên, những nỗ lực sau này để tăng số lượng chồi bằng cách tăng nồng độ NAA lên 1 mg/L kết hợp với 4 mg/L BAP đã bị thất bại (Bảng I). Mặc dù nồng độ đáng kể của BAP (2-4 m/L) và NAA(1 mg/L) được thêm vào môi trường nhưng phần lớn chồi không kéo dài (so sánh các hình 1 và 2). Các bổ sung GA3 0.1 mg/L vào môi trường đã không kích thích bất kỳ sự tăng trưởng đáng kể nào và chỉ có tối đa là 3.8 chồi/mẫu vật, và chúng phát triển không có gì khác biệt đáng kể so với không sử dụng GA3 (Bảng I).
Bảng I. Ảnh hưởng của việc bổ sung BAP, NAA và GA vào môi trường cơ bản lên số lượng chồi sinh ra từ trụ dưới lá mầm sau sáu tuần nuôi cấy. Giá trị trung bình ± SE của 12 lần lặp lại cho mỗi nghiệm thức
|
Chất điều hòa sinh trưởng (mg/L) |
Số lượng chồi/mẫu vật |
|
BAP |
NAA |
GA3 |
|
2.0 |
0.5 |
0.1 |
3.3 ± 0.5 |
|
2.0 |
1.0 |
0.1 |
2.9 ± 0.6 |
|
4.0 |
1.0 |
0.1 |
3.8 ± 0.5 |
|
4.0 |
1.0 |
0 |
4.2 ± 0.8 |
Các mẫu vật mang mắt ngủ được cắt từ cây trưởng thành, đã được đặt trong môi trường có BAP mà không có NAA, số lượng chồi phát triển từ chồi nách ngày càng tăng khi tăng nồng độ BAP (Hình 3). Tuy nhiên, số lượng chồi tối đa đạt được ở 2 mg/L BAP và 0.1 mg/L NAA. Mặc dù với nồng độ NAA 0.5 mg/L tăng đáng kể số chồi khi kết hợp với 0.5 mg/L BAP, nhưng nó đã trở thành ức chế khi BAP ở các nồng độ cao hơn.
Hình 3. Ảnh hưởng của BAP và NAA lên số lượng chồi được sinh ra trên các mẫu vật là chồi ngủ từ cây trưởng thành sau 6 tuần nuôi cấy. Giá trị trung bình của 15 lần lặp lại cho mỗi nghiệm thức. Các thanh dọc thể hiện sai số chuẩn của giá trị trung bình.
Các điều kiện vật lý của môi trường
Các mẫu vật cây chưa trưởng thành và cây trưởng thành của mãng cầu xiêm A. muricata (P = 0.05) nuôi trong môi trường chất lỏng tăng nhanh hơn đáng kể so với môi trường bán rắn, được đánh giá thông qua số lượng chồi, chiều dài lá và chiều dài của đốt (Bảng II). Số lượng lá tương tự nhau ở cả hai môi trường.
BẢNG II
Ảnh hưởng của điều kiện vật lý (bán rắn hoặc lỏng) của môi trường lên số lượng chồi, số lượng lá, chiều dài lá và chiều dài của đoạn thân có nguồn gốc từ các vật liệu chưa trưởng thành và trưởng thành của mãng cầu xiêm A. muricata. Năm lần lặp lại cho mỗi nghiệm thức
|
|
Bán rắn |
Lỏng |
Phương sai giới hạn |
|
Chưa trưởng thành |
Trưởng thành |
Chưa trưởng thành |
Trưởng thành |
|
Số lượng chồi |
4.5 |
3.6 |
5.3 |
5.0 |
1.03* |
|
Số lượng lá |
7.0 |
7.2 |
8.0 |
8.2 |
1.56 n.s |
|
Chiều dài lá |
8.0 |
9.0 |
14.0 |
15.0 |
2.0* |
|
Chiều dài đoạn thân |
3.0 |
4.0 |
9.0 |
11.0 |
0.9* |
Xử lý ra rễ
Khi NAA 4 mg/L được cho vào môi trường bán rắn (mẫu đối chứng) có tỉ lệ ra rễ là 50% và 40%, và giá tị trung bình số rễ là 2.4 và 1.5 rễ/mẫu vật, số liệu này tương ứng với mẫu vật là cá thể chưa trưởng thành và cá thể trưởng thành (Bảng III). Tuy nhiên, nếu cùng nồng độ NAA được cho qua môi trường lỏng trong bóng tối trong 15 ngày, trước khi chuyển mẫu vật đến môi trường WPM, tỷ lệ là 66% và 58% và số lượng rễ trung bình là 2.4 và 2.2 rễ trên mỗi mẫu vật, tương ứng với mẫu vật là cá thể chưa và đã trưởng thành. Việc không thêm vào môi trường lỏng các nồng độ NAA khác nhau cũng như không ngâm phần bị cắt của các mẫu vật vào NAA ở nồng độ rất cao có thể phù hợp với các kết quả này (Bảng III).
Bảng III. Ảnh hưởng của phương pháp áp dụng và thời gian xử lý với NAA lên sự ra rễ của mẫu vật chưa trưởng thành và trưởng thành ở cây mãng cầu xiêm A. muricata sau 30 ngày nuôi cấy. 12 lần lặp lại cho mỗi nghiệm thức
Vật liệu
|
|
Vật liệu |
|
Chưa trưởng thành |
Trưởng thành |
Chưa trưởng thành |
Trưởng thành |
|
Nồng độ NAA (mg/L) |
Thời gian |
Phương pháp xử lý |
Tỉ lệ ra rễ (%) |
Số lượng rễ trung bình |
|
4 |
5 ngày |
Lỏng |
25 |
25 |
1.3 |
1.7 |
|
4 |
15 ngày |
Lỏng |
66 |
58 |
2.4 |
2.2 |
|
4 |
30ngày |
Lỏng |
33 |
25 |
2.0 |
1.7 |
|
16 |
5ngày |
Lỏng |
42* |
33* |
2.1 |
1.4 |
|
16 |
15 ngày |
Lỏng |
17* |
17* |
1.5 |
1.4 |
|
64 |
5 phút |
Lỏng |
17* |
8* |
2.0 |
0 |
|
500 |
1 phút |
Lỏng |
17 |
17 |
1.5 |
1.0 |
|
500 |
3 phút |
Lỏng |
33 |
17 |
1.7 |
1.0 |
|
1000 |
1 phút |
Lỏng |
25 |
0 |
1.3 |
0 |
|
1000 |
3 phút |
Lỏng |
33* |
8* |
1.5 |
1.0 |
|
**4 |
4 tuần |
Bán rắn |
50 |
42 |
2.4 |
1.5 |
Các biến thể môi trường và nguồn carbon
Phần đoạn cắt từ trụ dưới lá mầm cho thấy khả năng ra rễ giảm đi khi cây đạt đến giai đoạn trưởng thành (Bảng IV). Moncousin (1991) ủng hộ ý tưởng này và gợi ý rằng cây thân gỗ có thể mất khả năng ra rễ thậm chí trước khi chúng ra hoa (trưởng thành). Galactose cho khả năng kích thích ra rễ cao nhất (100% và 70% trong WPM đối với cá thể chưa trưởng thành và trưởng thành) so với sucrose ở cả hai mức độ được nghiên cứu (Bảng IV). Cũng như tăng tỷ lệ ra rễ, galactose cũng tăng cường số lượng rễ được tạo ra từ các mẫu vật trưởng thành, từ 1.2 đến 2.4 rễ trên mỗi mẫu vật (Hình 4A) và từ 1.9 đến 3.2 ở các mẫu vật chưa trưởng thành (Hình 4B) trong môi trường WPM.
Thích nghi khí hậu cho cây con
Tất cả các cây đã ra rễ sống sót khi trồng vào khoáng Vermiculite, cho dù rễ có số lượng hay kích thước ra sao thì tất cả các cây đều nảy ra ít nhất một lá mới sau 2 tuần trồng.
THẢO LUẬN VÀ KẾT LUẬN
Các quy trình được trình bày ở đây đã xác lập các điều kiện để nhân rộng mãng cầu xiêm A. muricata từ hai loại mẫu vật: 1) chưa trưởng thành/cây non, sử dụng trụ dưới lá mầm của cây con nảy mầm trong điều kiện vô trùng, và 2) trưởng thành, sử dụng các đoạn thân mang mắt ngủ lấy từ cây ba năm tuổi đã nở hoa trong nhà kính. Việc sử dụng 2 mg/L BAP kết hợp với 0.5 mg/L NAA là điều cần thiết cho sự phát triển chồi trong các mẫu vật trụ dưới lá mầm. Một số lượng lớn mầm (bud) nảy trên bề mặt trụ dưới lá mầm đã chỉ ra sự tồn tại của nhiều locus có khả năng đáp ứng các kích thích in vitro để sản xuất ra chồi bất định. Đặc điểm này có lẽ liên quan đến bản chất nguyên sơ của mẫu vật, như một khả năng tương tự đã được báo cáo cho mãng cầu tây A. cherimola (Jordan, 1988) và A. muricata (Bejoy và Hariharan, 1992). Các đoạn thân trưởng thành mang mắt ngủ cũng cần 2 mg/L trong BAP nhưng với NAA cao hơn (0.1 mg/L) so với trụ dưới lá mầm. Phản ứng khác nhau giữa hai loại mẫu vật khi dùng cùng nồng độ BAP và NAA có thể liên quan đến nồng độ cytokinin và auxin nội sinh có trong các mẫu vật ban đầu. Tuy nhiên, số lượng chồi từ những mẫu vật trưởng thành và thời gian để kéo dài thân của chúng cần được cải thiện hơn nữa. Có thể các chồi xuất hiện đầu tiên hoặc phát triển nhanh hơn đã ức chế sự kéo dài của những chồi khác. Konar và Konar (1973) cho rằng gibberellin có thể liên quan đến khả năng kéo dài chồi ở trụ dưới lá mầm của cây mao lương Ranunculus scieratlls, nhưng trong nghiên cứu này, việc bổ sung GA3 không tạo ra sự kéo dài đáng kể của chồi.
Tính chất vật lý của môi trường có thể ảnh hưởng đến tỷ lệ hấp thụ các hợp chất từ môi trường nuôi cấy và điều này giải thích cho sự tăng trưởng được cải thiện trong môi trường lỏng. Ngọn chồi của cây táo phát triển trong môi trường lỏng lắc nhanh hơn trong môi trường agar (Snir và Erez, 1980). Trọng lượng khô của ngọn đào được nuôi trong môi trường lỏng, trong ống lăn, nặng gấp ít nhất là ba lần so với môi trường 0.6% agar (Hammerschlag, 1982). Trong môi trường bán rắn, tất cả các chất dinh dưỡng được hấp thụ bởi một phần nhỏ của mẫu vật tại vị trí tiếp xúc với môi trường. Debergh (1982) đã quan sát thấy rằng nếu như vùng tiếp xúc của mẫu vật với dung dịch lớn hơn thì có thể tăng cường sự hấp thụ các hợp chất mong muốn và do đó làm tăng tốc độ tăng trưởng của các mẫu vật được nuôi cấy, như đã trình bày ở đây với mãng cầu xiêm A. muricata.
Bảng IV. Ảnh hưởng của môi trường cơ bản và nguồn carbon lên tỷ lệ ra rễ sau 4 tuần nuôi cấy của mãng cầu xiêm A. muricata. 12 lần lặp lại cho mỗi nghiệm thức
|
Sugar |
Nồng độ (g/L) |
Môi trường |
|
MS |
1/2 MS |
WPM |
NN |
|
Juv |
Mat |
Juv |
Mat |
Juv |
Mat |
Juv |
Mat |
|
Sucrose |
20 |
50 |
50 |
60 |
40 |
60 |
40 |
50 |
40 |
|
Sucrose |
30 |
30 |
10 |
30 |
30 |
50 |
30 |
40 |
20 |
|
Galactose |
10 |
90 |
60 |
80 |
60 |
100 |
70 |
70 |
50 |
Hình 4. Ảnh hưởng của môi trường cơ bản và nguồn carbon lên số lượng rễ được sinh ra ở các cá thể chưa trưởng thành (A) hoặc trưởng thành (B) sau bốn tuần nuôi cấy. Số lượng trung bình của rễ sinh ra trên mẫu vật ở mỗi nghiệm thức. Các thanh dọc đại diện cho sai số chuẩn. MS = Môi trường của Murashige và Skoog, WPM = Môi trường cho cây thân gỗ, NN = Môi trường Nitsch và Nitsch. 15 lần lần lặp cho mỗi nghiệm thức.
Sự di chuyển của các mẫu vật trong hai tuần nuôi lắc trong môi trường đơn giản có chứa 3 g/L than hoạt tính, trước khi kích thích rễ, đã cải thiện khả năng bắt rễ của chúng. Môi trường lỏng chứa 4 mg/L NAA, trong 15 ngày, trong bóng tối đã cho rễ tối đa. Các phản ứng của rễ ở các mẫu vật trưởng thành đã được cải thiện bằng cách sử dụng galactose thay vì sucrose như là nguồn đường trong môi trường cấy. Galactose không phải là loại đường thường được sử dụng trong nuôi cấy mô. Loại đường này đã được báo cáo là có tính ức chế hoặc độc đối với rễ khi được tự do trong môi trường nuôi cấy (ví dụ như Hughes và Street, 1974; Tanimoto và cộng sự, 1989; Farrar và cộng sự, 1994). Tuy nhiên, galactose là thành phần phổ biến của nhiều chất polyme trong thực vật và thành phần chính của một số loại đường có trong một lượng nhỏ trong nhựa cây của nhiều loài thực vật. Một trong số các loại đường này (ví dụ: raffinose và stachyose), mặc dù hiện diện với số lượng nhỏ hơn so với sucrose trong nhựa trong mạch libe của A. muricata (Zimmerman và Ziegler, 1975), nhưng lại quan trọng trong quá trình ra rễ. Mặc dù có sự gia tăng rễ tương đối cao (70%), khi sử dụng galactose làm nguồn carbon, nhưng điều này cần phải được cải thiện vì đường này có thể làm tăng chi phí vi nhân giống. Vì thế, các thử nghiệm để cải thiện sự ra rễ bất định đã sử dụng sucrose như là nguồn carbon duy nhất cho A. muricata nên được tiến hành tiếp tục. Việc sử dụng các môi trường nuôi cấy lỏng được gợi ý cho hệ thống nhân giống giúp cây trồng phát triển nhanh hơn. Tuy nhiên, phải cẩn thận với nguy cơ mắc phải thể thủy tinh.
Ngay cả khi số lượng rễ còn ít, tất cả các cây đều sống sót qua quá trình thích nghi khí hậu đã nhanh chóng hình thành những lá mới. Do đó quá trình nhân giống cho mãng cầu xiêm A. muricata đã được chứng minh thành công. Như vậy đã có sẵn một công cụ bảo tồn và trao đổi nguồn gen và có thể được phát triển để làm vật liệu cải tiến cho nông dân ở vùng nhiệt đới.
Nhóm tác giả cảm ơn bà J. Lancefield đã giúp đỡ chuẩn bị cho bài báo này được xuất bản. EEPL xin gửi lời cảm ơn đến Hội đồng phát triển Khoa học và Công nghệ Brazil (CNPq) đã hỗ trợ công việc này.
TÀI LIỆU THAM KHẢO
BEJOY, M. and HARIHARAN, M. (1992). In vitro plantlet differentiation in Annona muricata. Plant Cell, Tissue and Organ Culture, 31, 245-7.
DEBERGH, P. C. (1982). Physical properties of culture media. In: Plant tissue culture 1982. (Fujiwara, A., Ed.). Proceedings of the 5th International Congress of Plant Tissue and Cell Culture, Japan, 135-6.
ENCINA, C. L., BARCEL6-MuNOZ, A., HERRERO-CASTANO, A. and PUEGo-ALFARO, F. (1994). In vitro morphogenesis of juvenile Annona cherimola Mill. bud explants. HortScience, 69, 1053-9.
FARRAR, J. F., MINCHIN, P. E. H. and THORPE, M. R. (1994). Carbon import into barley roots: stimulation by galactose. Journal of Experimental Botany, 270, 17-22.
GEORGE, A. P. and NISSEN, R. J. (1987). Propagation of Annona species: a review. Scientia
Horticulturae, 33, 75-85.
HAMMERSCHLAG, F. (1982). Factors affecting establishment and growth of peach shoots in vitro. HortScience, 17, 85-6.
HUGHES, R. and STREET, H. E. (1974). Galactose as an inhibitor of the expansion of root cells.
Annals of Botany, 38, 555-64.
JORDAN, M. (1988). Multiple shoot formation and rhizogenesis from cherimola (Annona cherimola L.) hypocotyls and petiole explants. Gartenbauwissenschaf~ 53 (5), 234-7.
JORDAN, M., ITURRIAGA, L., ROVERARO, C. and GOREUX, A. (1991). Promotion of Annona cherimola in vitro morphogenesis as influenced by antioxidants. Gartenbauwissenschaft, 56 (5), 224-7.
KONAR, R. N. and KONAR, A. (1973). Interaction of CCC and gibberellic acid in the morphogenesis of Ranunculus scleratus tissue in vitro. Phytomorphology, 23, 105-9.
LLOYD, G. and MCCOWN, B. (1980). Use of microculture for production and improvement of Rhododendron spp. HortScience, 15,416.
LLOYD, G. and MCCOWN, B. (1981). Commercially-feasible micropropagation of mountain laurel, Kalmia latifolia, by use of shoot tip culture. Combined Proceedings ofthe International Plant Propagators' Society, 30, 421-7.
MONCOUSIN, C. (1991). Rooting of microcuttings. Acta Horticulturae, 289, 301-27.
MORAES, J. L. (1979). Estudo de fenolase em graviola (Annona muricata L.). DissertaoUniversidade Federal da Parafba, J. Pessoa, Brasil.
MURASHIGE, T. and SKOOG, F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum, 15,473-9.
NAIR, S., GUPTA, M. V. and MASCARENHAS, A. F. (1984a). In vitro propagation of annona hydrid (Annona squamosa L. X Annona cherimola L.). Indian Journal of Horticulture, 41, 160-5.
NAIR, S., GUPTA, M. V., SHIRGURKAR, M. V. and MASCARENHAS, A. F. (1984b). In vitro organogenesis from leaf explants of Annona squamosa Linn. Plant, Cell Tissue and Organ Culture, 3, 29-40.
NITSCH, J. P. and NITSCH, C. (1956). Auxin-dependent growth of excised Helianthus tissues. American Journal of Botany, 43, 839-5l.
SNIR, 1. and EREZ, A. (1980). In vitro propagation of Mailing Merton apple rootstocks. HortScience, 15, 597-8.
TANIMOTO, E., SCOTT, T. K. and MASUDA, Y. (1989). Inhibition of auxin-enhanced elongation of Zea mays root segments by galactose. Plant Physiology, 90, 440-4
ZIMMERMAN, M. H. and ZIEGLER, H. (1975). List of sugars and sugar alcohols in sieve-tube exudates. Encyclopedia ofplant physiology. (Pirson A. and Zimmerman, M. H., Eds). New Series Vol I, Springer, Berlin, 480-503.
(Chấp nhận đăng: 23/11/1995)
Khải Mùi
SBC Scientific