Nhân giống in vitro Cây địa liền Kaempferia Galanga (Zingiberaceae) và so sánh hoạt tính diệt ấu trùng và sự đồng nhất của các hợp chất tự nhiên chiết ra từ cây nuôi cấy mô với cây trồng tự nhiên. Môi trường sử dụng là MS, hormone sử dụng là BAP, IAA, IBA.
Tóm tắt
Nhân giống sinh dưỡng K. galanga Linn (Zingiberaceae) không thể đáp ứng đủ cây con cho việc gieo trồng. Nuôi cấy mô là giải pháp thay thế cung cấp nguồn cây con cho việc nhân giống. Các nghiên cứu được thực hiện về nhân giống cây trồng thông qua sự phát sinh cơ quan trực tiếp và so sánh hoạt tính diệt ấu trùng và các hợp chất tự nhiên hiện diện trong mô thân rễ của “cây trồng tự nhiên và cây nuôi cấy mô” để xác định tiềm năng của nuôi cấy mô như 1 sự thay thế cho thực vật tự nhiên trong sản xuất thương mại. Sự cảm ứng tạo mô chồi non được tối ưu hóa trên môi trường MS được bổ sung 2.0 mg/L Benzyl amino purine (BAP) và 0.5 mg/L IAA (Indole-3-acetic acid). Môi trường MS bổ sung thêm 1.0 mg/L IAA và 0.2 mg/L Indol-3-butric acid (IBA) được xác định là môi trường phù hợp nhất để cảm ứng rễ. Cây non bén rễ thích nghi thành công 100% trong hỗn hợp đất : cát : phân (1:1:1). Hexane là dung môi tách chiết các hợp chất tự nhiên tốt hơn methanol và 50% cao chiết hexane cho thấy hoạt tính diệt ấu trùng ở giai đoạn thứ 4 của A. aegypti. Phân tích GC-MS chứng minh sự tồn tại của 9 hợp chất chìa khóa trong cả 2 mẫu được kiểm tra, xác thực khả năng sử dụng thực vật nuôi cấy mô như một nguồn thay thế cho thực vật tự nhiên để điều chế thuốc.
Từ khóa: Thí nghiệm sinh học; Bảo tồn; Nuôi cấy mô; GC-MS; K. galangal
Từ viết tắt: BAP: Benzyl Amino Purine; IBA: Indol-3-Butric Acid; IAA: Indole-3-Acetic Acid; MS: Murashige và Skoog; RDB: Randomized Block Design; EMC: Ethyl p-Methoxy Cinnamate

Giới thiệu
Kaempferia galanga Linn (Zingiberaceae) phân bố chủ yếu ở Đông Nam Á và Trung Quốc [1] và nó là thành phần chính của thuốc điều chế truyền thống của hệ thống y học Ayurveda [2]. Tinh dầu trong thân rễ là hợp chất bay hơi và nó được sử dụng trong gia vị, đồ uống và trong nước hoa cũng như trong nền công nghiệp mỹ phẩm [3,4]. Lá và hoa chứa chất flavonoids [5]. Nhiều thành phần của cao chiết thân rễ chứa ethyl-p-methoxycinnamate, ethyl cinnamate, 3-carene, camphene, borneol, cineol, kaempferol và kaempferide, đó là những chất chịu trách nhiệm cho đặc tính của K. galanga [3].Thân rễ của thực vật được báo cáo có chứa chất kích thích, giúp xì hơi, lợi tiểu và dễ tiêu [6]. K. galangal cũng có các đặc tính sinh học như kháng khuẩn, kháng vi sinh, kháng ung thư, diệt ấu trùng, diệt amip và có các hoạt tính dược lý như giảm căng mạch máu và chống viêm [7]. Giống cây này đang được khai thác và liệt vào danh sách bị đe dọa ở Sri Lanka và India và ở nhiều quốc gia Đông Nam Á khác. Do đó, sự phát triển công nghệ nuôi cấy mô để nhân giống K. galangal có thể giúp bảo tồn cây thuốc quan trọng này. Ước tính tiềm năng sử dụng của cao chiết từ cây tự nhiên và cây nuôi cấy mô trong hoạt động trừ sâu có lợi trong việc sử dụng cây nuôi cấy mô như một biện pháp thay thế cho cây trồng tự nhiên. Mặc khác, Việc tăng sử dụng bình xịt muỗi ở nơi công cộng có thể gây ung thư. Như 1 nghiên cứu mở đầu, bột thân rễ của K. galangal tự nhiên và nuôi cấy mô chứa chất chống muỗi cũng được đánh giá trong nghiên cứu này. Có khả năng có 1 con đường sinh hóa thay thế trong suốt quá trình nuôi cấy mô bởi vì sự tiếp xúc liên tục với lượng lớn chất điều hòa thực vật. Do đó, việc so sánh lượng hợp chất tự nhiên có trong thân rễ của cây tự nhiên và cây nuôi cấy mô là cần thiết nếu thực vật nuôi cấy mô được dùng để thay thế thực vật tự nhiên.
Vật liệu và phương pháp
Tất cả các thí nghiệm nuôi cấy mô đều dùng môi trường Murashige và Skoog (MS) [8] có bổ sung 30.0 g/L sucrose và thạch rêu (8.0 g/L) là chất làm đông. pH của môi tường được chỉnh đến 5.8. Nếu không có quy định khác, mỗi phép thử được lặp lại 20 lần. Randomized Block Design (RDB) được sử dụng trong mọi thí nghiệm và bình nuôi cấy được lấy ngẫu nhiên sau 7 ngày. Thực vật được nuôi tại nhiệt độ 25±1°C với chu kỳ quang là 16h. Kết quả được phân tích bằng Minitab statistical package.
Nhân giống in vitro K. galangal từ chồi nách
Cảm ứng rễ và nhân lên: Thân rễ của K. galangal được bao bọc trong giấy ướt để chồi nách phát triển. Chồi nách được tách rời cẩn thận khỏi thân rễ và bắt đầu rửa bằng 5% Clorox (5.25% NaOCl™) trong 15 phút và được chuyển vô trong tủ cây. Sau đó, chúng được rửa bằng 10% Clorox và 70% ethanol, sau đó rửa bằng nước cất vô trùng 2 lần trước khi chuyển vô trong môi trường cấy. Mô được nuôi cấy trong môi trường MS có bổ sung 1.0-3.0 mg/L BAP (Benzyl amino purine) và 0.2-1.0 mg/L IAA (Indole-3-acetic acid). Môi trường MS không có chất điều hòa tăng trưởng được sử dụng để đối chứng. Số lượng chồi trung bình trên mỗi chồi nách và chiều dài trung bình của chồi được quan sát hàng tuần trong 4 tuần nuôi cấy
Cảm ứng rễ từ chồi in vitro: Để cảm ứng rễ, chồi in vitro được kéo dài (≥3.0 cm) được tiếp tục nuôi cấy trên môi trường như ban đầu hoặc tách ra sau 3 tuần nuôi cấy và chuyển qua môi trường MS có bổ sung IBA (0.0 -1.0 mg/L) và 1.0 mg/L IAA. Nồng độ thạch rêu được tăng lên 7.0 g/L. Số lượng rễ tạo thành và chiều dài rễ được ghi chép hàng tuần trong thời gian 4 tuần.
Sự thích nghi của cây con nuôi cấy mô: Cây con đã ra rễ sẽ được làm sạch cẩn thận bằng nước Luke để loại bỏ mọi dấu vết của agar. Chúng được nhúng vô dung dịch diệt nấm và được đặt trong chậu cây chứa hỗn hợp đất : cát : phân (1:1:1) hoặc hỗn hợp đất : vỏ trấu (1:1 và 1:2) để thích nghi. Chúng được đặt ở nơi có màn che trong 2 tuần và sau đó được chuyển ra đất. Tỷ lệ cây sống được đánh giá sau 4 tuần trồng cây trong môi trường bình thường.
Xác định hoạt tính diệt ấu trùng của thân rễ cây K. galangal tự nhiên và nuôi cấy mô.
Phần thân rễ được thu thập từ cây nuôi cấy cũng như cây tự nhiên sau 8 tháng trồng, phơi khô và tán thành bột. Cứ mỗi 100g bột thân rễ được thêm 500 mL hexane và ngâm tại nhiệt độ phòng và sau đó được lọc qua phễu thí nghiệm. Phần lọc được cô đặc bằng máy cô quay tại 40oC. Để thu cao chiết methanol, thêm 500 ml 85% methanol vào 100g bột của mỗi mẫu trong 12h trong bộ chiết Soxhlet . Mẫu thô thu được từ cao chiết hexane và methanol được hòa tan trong 100ml nước cất để thử hoạt tính diệt ấu trùng. Cao chiết nước được chuẩn bị đơn giản bằng trộn bột K. galangal với 100ml nước sôi để qua đêm ở nhiệt độ phòng. Những nồng độ khác nhau (10%, 25%, 50% và 100%) của cao chiết hexane, methanol và nước được dùng để kiểm tra tính diệt ấu trùng giai đoạn 4 của Aedes aegypti. Ấu trùng (10 con ở mỗi cốc 10ml) được thêm vào 20ml dung dịch cần kiểm tra. Nước được sử dụng làm đối chứng. Tỷ lệ chết được quan sát hàng giờ trong 24h và được tính toán bằng công thức sau:
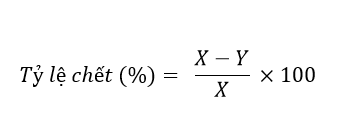
Trong đó:
X: Phần trăm sống của nghiệm thức đối chứng
Y: Phần trăm sống trong nghiệm thức các mẫu thử
Đặc tính đuổi muỗi của bột thân rễ khô của K. galangal tự nhiên và nuôi cấy mô . Những con muỗi trưởng thành được lựa chọn ngẫu nhiên tử những loài khác nhau (A. aegypti, A. albopictus, Culex sp. và Armigerous sp.) được sử dụng trong thí nghiệm này. Mẫu kiểm tra cho đặc tính đuổi muỗi được chuẩn bị bằng cách trộn bột K. galangal với tinh bột như 1 chất nền. Bột K. galangal nguyên chất (1.0 g hoặc 2.0 g) hoặc trộn với tinh bột theo theo tỷ lệ (0.75:0.25) được dùng để kiểm tra và tinh bột nguyên chất dùng để làm đối chứng. Những con muỗi trưởng thành (mỗi nghiệm thức 15 con) được tiếp xúc với mẫu kiểm tra đã được chuẩn bị sẵn trong thời gian chúng hoạt động (5.00-7.00pm mỗi tối) bằng cách đặt hỗn hợp mẫu thử bên trong lồng nuôi (0.5×0.5×0.5 m3 ). Khoảng cách xua đuổi muỗi được ghi chép 15 phút 1 lần bằng cách sử dụng hệ thống phân chia đặt trong lồng
So sánh sự hiện diện của các hợp chất tự nhiên trong thân rễ của K. galangal tự nhiên và nuôi cấy mô.
Thân rễ khô của K. galangal tự nhiên và nuôi cấy mô (mỗi loại 10g) được nghiền thành bột và tách chiết độc lập với 250.0 ml của Hexane bằng bộ chiết Soxhlet trong 3h. Sau đó cao chiết hexane được cô đặc lại còn 1.0-2.0 ml bằng máy cô quay (BUCHI R300). Sau đó đem cao chiết được cô đặc đi phân tích GC-MS. Sắc phổ được quan sát và cấu tạo của các chất trong mẫu được xác định.
Kết quả và thảo luận
Nhân giống in vitro K. galangal từ chồi nách
Cảm ứng rễ và nhân lên: Sự kéo dài chồi nách in vitro được quan sát sau 2 tuần nuôi cấy (Hình 1) trong mọi môi trường dùng trong thí nghiệm. Môi trường MS bổ sung 2.0 mg/L BAP và 0.5 mg/L IAA cho thấy sự kéo dài nhiều nhất (214.90 ± 0.10 cm) cũng như tốc độ nhân lên nhanh nhất (12.0± 0.02). Nồng độ BAP được tăng lên (3.0 mg/L) với 0.5 mg/L IAA làm tăng sự kéo dài chồi cây (2.25 ± 0.21) cũng như tốc độ nhân lên (3.0 ± 0.10) sau 4 tuần nuôi cấy. Môi trường MS không có chất điều hòa tăng trưởng (môi trường đối chứng) cho thấy đáp ứng chậm trong nuôi cấy cũng như sự kéo dài chồi cây in vitro (Bảng 1). Cảm ứng chồi cây in vitro trong môi trường MS được bổ sung BAP (0.3 mg/L) và IBA (0.15 mg/L) [9] và IBA (2.7 mg/L) và NAA (0.55 mg/L) [10] đã được báo cáo. Trong nhiều nghiên cứu, Kin (Kinetin) cũng từng được sử dụng để cảm ứng chồi cây in vitro. Đã có báo cáo cho thấy tốc độ nhân lên cao nhất (8.2± 0.21) trong môi trường có bổ sung 3.0 mg/L BAP và 4.0 mg/L Kin [11] và cảm ứng nhân chồi cây trong môi trường MS có bổ sung IBA (0.49 mg/L, Kin (2.99 mg/L) [12] cũng được báo cáo. Tuy nhiên tỷ lệ tăng trưởng được báo cáo trong tất cả các nghiên cứu trên đều thấp hơn so với nghiên cứu này của chúng tôi cho thấy môi trường MS có bổ sung 2.0 mg/L BAP và 0.5 mg/L IAA là môi trường tốt nhất cho sự kéo dài và nhân lên của K. galanga.

Hình 1:
- Chồi nách cảm ứng từ thân rễ
- Chồi cây được kéo dài
- Sự nhân chồi và cảm ứng rễ
- Cây đã được thích nghi
- Sự phát triển của cây nuôi cấy mô sau 8 tuần
Cảm ứng rễ từ chồi in vitro: Chồi nhân giống in vitro được chuyển sang môi trường cảm ứng chồi để tạo rễ, tuy nhiên cảm ứng tạo rễ cần thời gian dài (10 tuần). Cảm ứng rễ trong môi trường nhân chồi đã được báo cáo [10,12]. IAA một mình không thể cảm ứng rễ. Sự kết hợp tốt nhất cho cảm ứng rễ in vitro đó là môi trường MS có bổ sung 0.2 mg/L IBA và 1.0 mg/L IAA với trung bình tỷ lệ chồi/rễ là 6.0±0.12 và chiều dài rễ là 39.8±1.11 mm. Sự tăng nồng độ IBA làm giảm mạnh cảm ứng rễ và kéo dài rễ (Bảng 2). Rễ được bắt đầu trong môi trường MS có bổ sung 0.4 mg/L BAP và 0.2 mg/L IBA sau khi được nuôi cấy thêm 12 tuần [9] chứng tỏ rằng IBA đóng vai trò quan trọng trong cảm ứng rễ ở K. galanga.
Sự thích nghi cùa cây con nuôi cấy mô: Tỷ lệ sống cao nhất 100% được quan sát khi cây con nuôi cấy mô được thích nghi trong hỗn hợp đất : cát : phân (1:1:1). Khi cây con được phát triển trong hỗn hợp đất : vỏ trấu (1:1) 80% cây sống được quan sát. Hỗn hợp đất : vỏ trấu (1:2) cho tỷ lệ sống thấp nhất (30%). Sự giảm khả năng giữ nước khi có lượng lớn vỏ trấu trong thí nghiệm này có thể là lí do cho tỷ lệ sống thấp của cây con trong hỗn hợp này. Sử dụng hỗn hợp trồng cây xốp với khả năng giữ nước tốt cho phép sự rút nước và làm thông phù hợp có thể cung cấp điều kiện tốt hơn cho sự thích nghi nhanh của cây in vitro.
Xác định hoạt tính diệt ấu trùng của thân rễ cây K. galangal tự nhiên và nuôi cấy mô.
Tỷ lệ chết của ấu trùng muỗi sau 24h nuôi trong các mẫu cao chiết khác nhau được tổng hợp trong bảng 3. Quan sát kết quả nhận được cho thấy hoạt tính diệt ấu trùng A. aegyptii giai đoạn 4 của cây nuôi cấy mô tương đối cao hơn so với cây trồng tự nhiên. Cao chiết hexane được nhận thấy có hoạt tính chống ấu trùng cao nhất trong khi cao chiết methanol và nước cho kết quả thấp hơn (Bảng 3). Nghiên cứu này cho thấy tỷ lệ chết cao nhất có thể thu được chỉ có 10%, đây là một tỷ lệ thấp. Tuy nhiên, K. galangal vẫn có tiềm năng sử dụng như là chất diệt ấu trùng nếu quá trình tách chiết cao được cải thiện. Khi so sánh kết quả của thí nghiệm này, chúng tôi thấy cao chiết hexane diệt ấu trùng muỗi Culex quinquefasciatus và đuổi muỗi A. aegypti hiệu quả, cả 2 đều là muỗi truyền bệnh nghiêm trọng. tính độc cuả ethyl cinnamate và ethyl p-methoxycinnamate (EMC) được tìm thấy trong thân rễ K. galangal và 12 hợp chất đã được biết đến khác đối với ấu trùng giai đoạn 3 của C. pipiens pallens Forskal, A. aegypti được kiểm tra và thấy rằng nó có thể được sử dụng như là chất kiểm soát muỗi tiềm năng giúp bảo vệ con người. [13,14]. Kaempferol là 1 flavonol tự nhiên, 1 dạng của flavonoid và tan chậm trong nước nhưng tan trong ethanol nóng và diethyl ether [15] xác nhận kết quả của nghiên cứu này, đó là cao chiết nước cho tỷ lệ chết thấp nhất. Tuy nhiên trong nghiên cứu này, chúng tôi quan sát thấy thành phần hợp chất tự nhiên có mặt trong cây nuôi cấy mô tương đối cao hơn so với cây tự nhiên. Điều đó thừa nhận rằng phương pháp nuôi cấy mô có thể là 1 phương pháp nhân giống thay thế cho K. galangal để thu thân rễ với hàm lượng hợp chất thứ cấp cao.
Bảng 1:
Thời gian kéo dài trung bình của chồi và số lượng trung chồi / mẫu trong các môi trường thí nghiệm khác nhau sau 4 tuần ủ
|
Hormone kết hợp (mg/L) |
Mean no. of Shoot/ |
Mean Shoot |
|
|
|
Mẫu cây ± SE |
Chiều dài (mm) ± SE |
|
BAP |
IAA |
|
|
|
Control |
1.0 ± 0.12 |
3.55 ± 1.65 |
|
1 |
0 |
3.0 ± 0.30 |
5.38 ± 0.11 |
|
1 |
0.5 |
7.0 ± 0.02 |
9.21 ± 0.11 |
|
1 |
1 |
4.2 ± 0.10 |
6.62 ± 0.12 |
|
2 |
0 |
2.5 ± 0.40 |
6.23 ± 015 |
|
2 |
0.5 |
12.0 ± 0.02 |
14.90 ±0.10 |
|
2 |
1 |
9.60 ± 0.09 |
11.91 ± 0.20 |
|
3 |
0 |
2.0 ± 0.20 |
2.11 ± 0.11 |
|
3 |
0.5 |
4.0 ± 0.50 |
3.00 ± 0.09 |
|
3 |
1 |
3.0 ± 0.10 |
2.25 ± 0.21 |
|
LSD 5% |
0.11 |
0.18 |
Bảng 2: Trung bình số rễ và độ dài trung bình của rễ trong môi trường MS bổ sung IAA 1,0 mg / L và nồng độ IBA khác nhau (0,0 -1,0 mg / L) sau 4 tuần ủ.
|
Nồng độ IBA (mg/L) |
Mean no. of Roots /Shoot |
Mean Root Length (mm) |
|
0.0 (Control) |
0 |
0 |
|
0.2 |
6.0±0.12 |
39.8±1.11 |
|
0.4 |
3.1±0.10 |
12.8±0.99 |
|
0.6 |
2.2±0.11 |
10.1±1.00 |
|
0.8 |
1.1±0.11 |
6.2±1.01 |
|
1 |
1.0±0.13 |
5.2±1.13 |
|
LSD 5% |
0.01 |
0.03 |
Bảng 3: Tỷ lệ chết của ấu trùng muỗi sau 24 giờ với nồng độ khác nhau của hexane, methanol và các chiết xuất nước của K. galanga.
|
|
Cây được nuôi cấy mô |
|
Cây tự nhiên |
|
|
Extract |
10% |
25% |
50% |
100% |
10% |
25% |
50% |
100% |
Control
(Nước) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Chất lỏng |
0 |
1 |
4 |
6 |
0 |
0 |
3 |
5 |
|
Methanol |
4 |
6 |
9 |
10 |
4 |
5 |
6 |
8 |
|
Hexane |
5 |
8 |
10 |
10 |
5 |
7 |
7 |
9 |
Đặc tính đuổi muỗi của bột thân rễ khô của K. galangal tự nhiên và nuôi cấy mô.
Khi muỗi trưởng thành được kiểm tra chống lại khả năng xua đuổi, mặc dù bột thân rễ K. galangal không giết muỗi trưởng thành nhưng khả năng di động của chúng bị ảnh hưởng. Chúng nghỉ ngơi trên lồng sau 25-30 phút (Hình 2a & 2b). Cao chiết của K. galanga gây trầm cảm thần kinh trung ương, giảm hoạt động của các cơ và giảm tỷ lệ hô hấp [15]. Khi bột thân rễ từ thực vật tự nhiên và nuôi cấy mô được thử nghiệm ở hai nồng độ cho hoạt động chống muỗi, khả năng di chuyển đối với thực vật tự nhiên cho thấy khoảng cách 24,16 ± 0,94, 28,31 ± 1,25 trong khi thực vật nuôi cấy mô cho thấy muỗi chứa trong 32,49 ± 0,5, 31,54 ± 0,54 khoảng cách tương ứng cho 1,0 g và 2,0 g. Không có sự khác biệt đáng kể được quan sát thấy khi bột khô thân rễ dùng trong hỗn hợp (0,75: 0,25) hoặc một mình (1,0 g) cho thấy việc sử dụng ít bột thân rễ cũng có thể đuổi muỗi. Khảo sát tài liệu cho thấy có rất ít báo cáo về hoạt động dược lý thần kinh của cây này. Trong nghiên cứu các chất giảm đau, cao chiết làm giảm đáng kể hoạt động vận động và thăm dò ở chuột Swiss albino. Các kết quả nghiên cứu trên chuột Swiss albino cho thấy tất cả các liều lượng thử nghiệm (100 và 200 mg / kg) của các cao chiết khác nhau của K. galanga đều cho thấy hiệu quả an thần đáng kể. Tác dụng trên phụ thuộc vào liều dùng, sự kéo dài và có ý nghĩa thống kê [15]. Cao chiết hexane của thân rễ đã được sử dụng để kiểm tra hoạt động chống muỗi [16]. Kết quả của nghiên cứu sơ bộ này có thể được sử dụng trong việc phát triển một loại thảo dược thương mại giúp chống lại các loài muỗi A.aegypti, A. albopictus, Culex sp. và Armigerous sp.- khi sử dụng một chất nền thích hợp thay vì tinh bột, thuận tiện hơn và tiết kiệm chi phí hơn
So sánh các hợp chất tự nhiên có trong thân rễ của cây K. galanga tự nhiên và nuôi cấy mô.
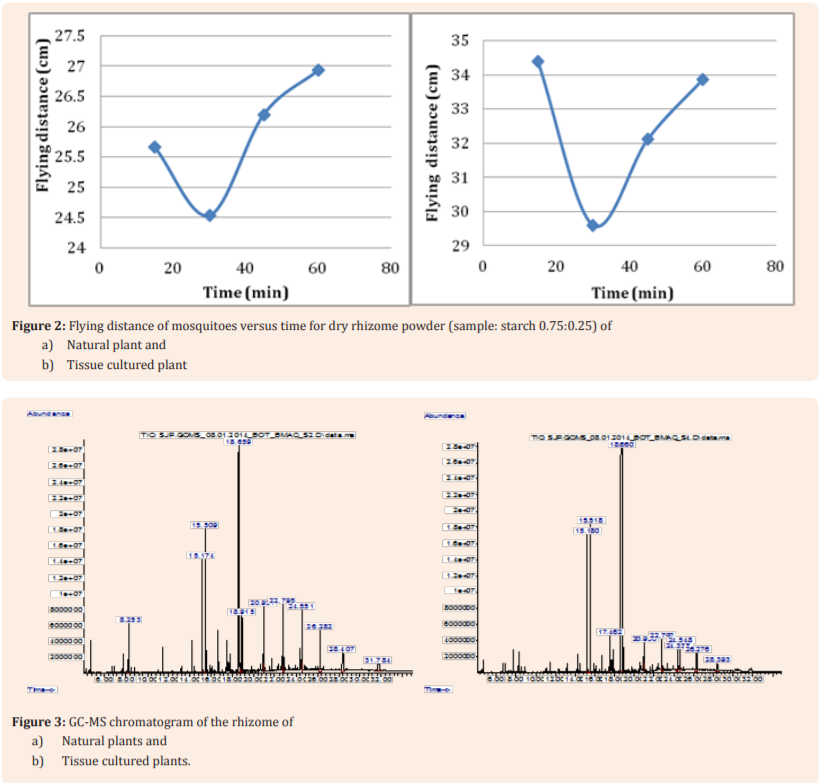
Tổng số 13 hợp chất được xác định từ mẫu thân rễ khô của cây tự nhiên (Hình 3a) và nhiều hợp chất cho thấy sự giống nhau đến hơn 90%, ngoại trừ Cyclopentane chỉ có 58% tương tự. Từ phân tích GC-MS trên cao chiết hexane, tổng cộng mười một hợp chất được xác định từ mẫu thân rễ khô của cây nuôi cấy mô (Hình 3b). Tất cả các hợp chất có trong thân rễ của K. Galanga nuôi cấy mô cho thấy sự giống nhau trên 90%, tuy nhiên, axit p-Hydroxycinnamic, este ethyl este có sự giống nhau 78%, tương đối thấp hơn mức tương tự của các hợp chất khác. Chúng tôi quan sát thấy rằng chín hợp chất tương đồng quan trọng là phổ biến trong mẫu thân rẽ tự nhiên và nuôi cấy mô. Ngoại trừ Borneol, tất cả các đặc tính của hợp chất tự nhiên khác cho thấy nhiều hay ít tương đồng. Sự hiện diện của Borneol trong cây tự nhiên cho thấy sự giống nhau 95%, trong khi đó 90% ở các cây nuôi cấy mô (Bảng 4). Điều này càng khẳng định tiềm năng sử dụng thân rễ cây lấy cấy mô làm thay thế cho thân rễ tự nhiên cây trồng trong ngành dược phẩm.
Kết luận
Phương pháp nuôi cấy mô được phát triển trong nghiên cứu này có thể được sử dụng như một phương pháp thay thế cho nhân giống sinh dưỡng và bảo tồn quần thể của K. Galanga vì các hợp chất tự nhiên được tìm thấy trong cây nuôi cấy mô tương tự như cây tự nhiên. Và số lượng các hợp chất tự nhiên quan trọng trong cây nuôi cấy mô cao hơn cho thấy việc sử dụng phương pháp nuôi cấy mô đã phát triển sẽ có lợi trong việc có được các cây với số lượng lớn hợp chất tự nhiên.
Bảng 4: Các hoạt tính thực vật ở trong nuôi cấy mô và cây tự nhiên
|
|
|
% Similarity |
|
Hợp chất |
Trọng lượng phân tử (g/mol) |
Tự nhiên |
Nuôi cấy mô |
|
Decane |
142 |
95 |
95 |
|
3-Carene |
136 |
97 |
96 |
|
Eucalyptol |
124 |
98 |
99 |
|
Borneol |
154 |
95 |
90 |
|
Dodecane |
170 |
96 |
96 |
|
2-propenoic acid, 3-phenyl-,ethyl ester (Ethylcinnamate) |
176 |
96 |
96 |
|
Pentadecane |
212 |
96 |
96 |
|
2-propenoic acid |
201 |
99 |
99 |
|
Heptadecenal |
252 |
99 |
97 |
Nguồn tham khảo:
1. Sala AV (1995) Indian medicinal plant. Orient Longman Ltd, India, 3: 274-275.
2. Ibemhal A, Laishram JM, Dhananjoy CH, Naorem B, Toijam R (2012) In vitro induction of multiple shoot and root from the rhizome of Kaempferia galanga L. Nebio J of Env and Biodi 3(3): 46-50.
3. Wong KC, Ong KS, Lim CL (1992) Composition of the essential oil of rhizome of Kaempferia galanga (L). Flavour Fragr J 7(5): 263-266.
4. Arambewela L, Silva R (1999) Sri Lankan medicinal plant monographs and analysis Volume 1, Kaempferia galanga. J of Nat Sci Foun, Sri Lanka, p. 5-21.
5. Ghani A (1998) Medicinal plants of Bangladesh: Chemical constituents and use. Asiatic Society of Bangladesh, Bangladesh, pp. 467.
6. Rahman MM, Amin MN, Ahamed T, Ali MR, Habib A (2004) Efficient plant regeneration through somatic embryogenesis from leaf basederived callus of Kaemferia galanga L. Asian J Plant Sci 3(6): 675678.
7. Kuen TG, Khaladalla MM, Bhatt A, Keng CL (2011) Callus induction and cell line establishment from various explants of Kaempferia galanga. International Journal of Current Research 3(12): 1-4.
8. Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum 15(3): 473-479.
9. Hettiarachchi A, Mendis MH, Ganeshan P, Jayewardene SDG (1994) Micropropagation of some medicinal plants of Sri Lanka, Proceedings of seminar held on 28th and 29th March 1994 at Plant Genetic Resource Centre, Gannoruwa, Sri Lanka, p. 59-65.
10. Shirin F, Kumar S, Mishra Y (2000) In vitro plantlet production system for Kaempferia galanga. Plant Cell, Tissue and Organ Culture 63(3): 193-197.
11. Bhattacharya M (2013) In vitro regeneration of pathogen free Kaempferia galanga L: A rare medicinal plant. Res in Plant Bio 3(3): 24-30.
12. Vincent KA, Mathew KM, Hariharan M (1992) Micropropagation of Kaempferia galanga L -a medicinal plant. Plant Cell Tiss Organ Cult 28(2): 229-230.
13. Kanjanapothi D, Panthong A, Lertprasertsuke N, Taesotikul T, Rujjanawate C, et al. (2004) Toxicity of crude rhizome extract of Kaempferia galanga L (Proh Hom). J Ethnopharmacol 90(2-3): 359365.
14. Kim NJ, Byun SG, Cho JE, Chung K, Ahn YJ (2008) Larvicidal activity of Kaempferia galanga rhizome phenylpropanoids towards three mosquito species. Pest Manag Sci 64(8): 857-862.
15. Ali MS, Ranjan Dash P, Nasrin M (2015) Study of sedative activity of different extracts of Kaempferia galanga in Swiss albino mice. BMC Complementary and Alternative Medicine 15: 158-165.
16. Choochote W (2011) Evidence to support karyotypic variation of the mosquito, Anopheles peditaeniatus in Thailand. J Insect Sci 11: 10.
Hoài Bảo
SBC Scientific