ẢNH HƯỞNG CỦA SALICYLIC ACID ĐẾN NHÂN GIỐNG IN VITRO VÀ KHẢ NĂNG CHỊU MẶN CỦA Hibiscus acetosella và Hibiscus moscheutos. (Luna red)
Hamidou F. Sakhan * and Rowena Y. Kelley2
1810 Hwy 26 West, PTN. Làm vườn Miền Nam, USDA-ARS, Poplarville, MS 39470.
2 Khoa Hoá sinh học và Sinh học phân tử, Đại học bang Mississippi State, P.O. Box 9650, bang Mississippi, MS
Nhận đăng: 9/2/2009
Tóm tắt:
Salicylic acid (SA) đã được báo cáo là cải thiện khả năng tái tạo in vitro cũng như tạo ra khả năng chịu stress phi sinh học ở thực vật. Ảnh hưởng của nồng độ SA khác nhau (0, 0.5 và 1 mM) trên các mẫu in vitro của hai loài Hibiscus, Hibiscus moscheutos (còn gọi là 'Luna Red') và Hibiscus acetosella, được nuôi cấy dưới nồng độ muối (NaCl) khác nhau (0, 175, và 200 mM) được đánh giá về sự tăng trưởng của thân và sự nhân chồi, sự hình thành rễ, sự kéo dài rễ, tỷ lệ sống của cây và sự tích lũy proline. Sử dụng SA, 0.5 mM cho tác động có lợi trên tất cả các thông số này ở cả hai loài trong điều kiện có và không có muối. Kết quả thu được cho thấy H. moscheutos có khả năng chịu mặn tốt hơn H. acetosella và SA có thể được sử dụng để cải thiện khả năng tái tạo in vitro và khả năng chịu mặn ở hai loài này. Hơn nữa, hệ thống tái tạo và sàng lọc in vitro được phát triển ở nghiên cứu này có thể kết hợp trong chương trình gây giống, giúp cho việc sàng lọc nhanh ban đầu, đánh giá sâu hơn và sự phát triển cuối cùng của cây Hibiscus chịu mặn.
Từ khóa: Hibiscus, in vitro, khả năng chịu mặn, salicylic acid.
GIỚI THIỆU
Độ mặn là một stress phi sinh học chủ yếu, và ngày càng ảnh hưởng đến sức khoẻ thực vật và sự sống còn của toàn thế giới. Nhiều mảnh đất đang trở nên mặn hóa do các phương pháp tưới tiêu địa phương kém (Winicov, 1998) và các hiện tượng tự nhiên như lũ lụt theo vùng định kỳ. Do đó, việc xác định và lựa chọn các loài thực vật chịu mặn là điều quan trọng. Tuy nhiên, việc phát triển các cây trồng chịu mặn bằng phương pháp nhân giống truyền thống đòi hòi nhiều lao động vì nó đòi hỏi một lượng lớn tài nguyên và không gian (Vijayan và cộng sự, 2003). Ngoài ra, khả năng chịu mặn của cây trồng có thể là một đặc điểm định lượng (Foolad và Jones, 1993), do đó đòi hỏi một quá trình lâu dài hơn trong việc lựa chọn cho tính trạng này. Do đó, có các phương pháp lựa chọn khác, như các hệ thống nuôi cấy in vitro, cần phải được khám phá vì các hệ thống này có thể được thực hiện trong điều kiện kiểm soát với không gian và thời gian hạn chế (Ghosal và Bajaj, 1984).
Salicylic acid (SA) là một chất giống như hormone đóng một vai trò quan trọng trong việc điều hòa sự tăng trưởng và phát triển của thực vật (Raskin, 1992). Trong hai thập kỷ qua, SA đã nhận được nhiều sự chú ý vì sự tham gia của nó vào các cơ chế bảo vệ thực vật dưới áp lực sinh học và phi sinh học. Các cơ chế bảo vệ này bao gồm việc thành lập hệ thống kháng tập nhiễm (systemic acquired resistance-SAR) (Mecroux và cộng sự, 1990) ), tạo nên protein gây tính kháng bệnh ở cây chủ (pathogenesis- related proteins-PR) (Malamy và cộng sự, 1990) cũng như là tạo ra tính "siêu mẫn cảm" ở thực vật ("hypersensitive response") (Horváth và cộng sự, 2007). Tác dụng bảo vệ của SA đối với các yếu tố stress phi sinh học như kim loại độc (Strobel và Kuc, 1995), stress nhiệt (Dat và cộng sự, 1998), nhiệt độ thấp (Janda và cộng sự, 1999, Mora- Herrera và cộng sự, 2005 ), và oxy hoá gây hại (Strobel và Kuc, 1995; Kusumi và cộng sự, 2006) đã được chứng minh. Hơn nữa, vai trò của SA trong việc tạo ra khả năng chịu mặn đã được nghiên cứu chi tiết ở nhiều loài thực vật. SA đã được báo cáo đã tạo ra khả năng chịu mặn trong cà chua (Stevens và cộng sự, 2006), ngô (Gunes và cộng sự, 2007), cà rốt (Eraslan và cộng sự, 2007) và lúa mỳ (Arfan và cộng sự, 2007). Nó cũng đã được sử dụng để tăng cường tái tạo in vitro ở một số loài thực vật (Quiroz-Figueroa và cộng sự, 2001, Luo và cộng sự, 2001, Hao và cộng sự, 2006). Tuy nhiên, không có nghiên cứu nào được thực hiện ở các loài Hibiscus, bao gồm Hibiscus acetosella và Hibiscus moscheutos, có nguồn gốc ở vùng nhiệt đới ở phía tây châu Phi (Menzel và Wilson, 1961) và Bắc Mỹ. H. acetosella, còn được gọi là 'false roselle' hay 'hibiscus lá đỏ', được trồng như là cây cảnh do có các đặc điểm hấp dẫn như lá đỏ tía, giống lá phong. H. moscheutos có hoa hấp dẫn rực rỡ. Cả hai loài này đều được trồng làm hoa trang trí ở vùng Vịnh của Hoa Kỳ, nơi thường xuyên bị ngập lụt ven biển xảy ra do những hiện tượng thời tiết cực đoan như bão, dẫn đến đất nhiễm mặn nhiều hơn. Mục tiêu của nghiên cứu này là để xác định, liệu việc áp dụng các nồng độ SA ngoại sinh lên nuôi cấy in vitro mô phân sinh ngọn có thể cải thiện được vi nhân giống và tạo ra tính chịu mặn của H. acetosella và H. moscheutos hay không.
VẬT LIỆU VÀ PHƯƠNG PHÁP
Cây giống và hạt nảy mầm in vitro
Hạt của hai loài này được làm sạch trong 15 phút sử dụng sulfuric acid 98%. Sau khi xử lý bằng acid, hạt được rửa sạch nhanh chóng và triệt để trong khoảng 5 phút với nước máy đang chảy để loại bỏ dư lượng acid. Sau đó, hạt được khử trùng bề mặt trong tủ vô trùng bằng cách nhúng chúng trong 100% ethanol trong 3 phút và lắc nhẹ. Hạt được chuyển vào các cốc 250 mL đã được khử trùng có chứa dung dịch NaOCl 40% (v / v) và một giọt TweenTM 20 (Sigma, MO, Mỹ) và rung trong 20 phút ở tốc độ 110 vòng/phút. Hạt sau đó được rửa bằng nước cất vô trùng và được bảo quản qua đêm trong nước cất vô trùng trên máy lắc ở tốc độ 110 vòng/phút. Ngày hôm sau, hạt được rửa lại 3 lần bằng nước cất vô trùng và chuyển vào đĩa Petri 95 x 15 mm (3 hạt/đĩa) chứa môi trường MS cơ bản (Murashige and Skoog, 1962) với 20 g/L sucrose, 0.75 mg/L MgCl2 và 2 g/L Gelrite.
Sử dụng SA
Chồi từ hạt nảy mầm được 3-5 ngày tuổi được cắt ra và chuyền vào bình 125 mL chứa 30 mL môi trường lỏng bao gồm muối khoáng của MS và vitamin B5 (Gamborg và cộng sự, 1968), 20 g/L sucrose, 0.2 g/L myo-inositol, 1 g/L casein hydrolysate, 1 mg/L thiamine, 0.6 μM thidiazuron (TDZ) và 8.9 μM N6-benzyladenin (BA). Tất cả các môi trường đã được hấp khử trùng trong 15 phút ở 121° C. Các thể tích phù hợp từ dung dịch stock, được lọc khử trùng, đã được thêm vào môi trường để đạt được nồng độ khác nhau (0, 0.5 và 1 mM) phù hợp với các nghiệm thức. Các bình chứa môi trường lỏng được lắc trong 24 giờ với 110 vòng/phút và 22°C
Các nghiệm thức chịu mặn
Sau 24 giờ, các phần mô phân sinh được xử lý SA cũng như các phần mô đối chứng (không được xử lý bởi SA) được chuyển tới các ống nghiệm 25 x 150 mm chứa 20 mL môi trường tương tự như môi trường lỏng được mô tả ở trên, ngoại trừ 0.75 g/L MgCl2 và 2 g/L Gelrit được thêm vào sau cùng để được các nghiệm thức muối khác nhau có 0, 175, và 200 mM NaCl.
Cho ra rễ và thích nghi khí hậu
Các cây không ra rễ sau 30 ngày nuôi cấy, được chuyển sang môi trường MS bổ sung 0.1 g/L IAA, vitamin Gamborg, 15 g/L sucrose, 0.75 g/L MgCl2 cũng như đủ Nồng độ NaCl cho mỗi lần thử nghiệm. Cây đã ra rễ được rửa nhẹ bằng nước máy để loại bỏ chất làm dẻo - agar và chuyển vào các viên than bùn Jiffy-7 (Jiffy Products, Ltd, Shippagan, Canada) và được bao phủ bởi các túi nhựa sạch (16.5 x 14.5 cm). Sau 3 ngày, đục lỗ trong túi nhựa để cho cây làm quen dần với khi hậu bên ngoài. Các cây trồng được tưới bằng nước muối (0, 175, 200 mM) khi cần. Các cây này được giữ trong phòng sinh trưởng ở 22 ° C với chu kì sáng/tối là 16/8 giờ (100 µmolm-2s-1)
Xác định Proline
Xác định Proline đã được thực hiện theo mô tả bởi Bates và cộng sự (1973). 0.5 g mô thực vật được đồng nhất trong 10 ml sulfosalicylic acid 3% và ly tâm ở tốc độ 11000 vòng/phút trong 15 phút. Sau đó, cho 2 ml dung dịch nổi ở trên trộn với ninhydrin acid và 2 mL axetic acid trong 1 giờ ở 100°C. Phản ứng được chấm dứt bằng cách đặt hỗn hợp lên đá lạnh. Hỗn hợp phản ứng sau đó được chiết xuất với 4 mL toluene và trộn mạnh trong 15-20 s và sắc tố có chứa toluen đã được hút từ pha nước, làm nguội đến nhiệt độ phòng và đọc ở bước sóng 520 nm (quang phổ kế Perkin-Elmer Lambda 3B UV / VIS , Oak Brook, IL, Mỹ) sử dụng toluen làm blank. Nồng độ proline được ngoại suy từ đường cong tiêu chuẩn và được tính trên cơ sở trọng lượng tươi như sau: [(μg proline/mL x mL toluene) /115.5 μg / μmol]/(g mẫu)/5] = μmol proline / g trọng lượng tươi vật chất. Acid ninhydrin được điều chế bằng cách làm ấm 1.25 g ninhydrin trong 30 ml acetic acid và 20 mL phosphoric acid 6 M và khuấy để hòa tan.
Thiết kế thử nghiệm và phân tích thống kê
Thử nghiệm là một thiết kế hoàn toàn ngẫu nhiên với độ lặp lại 20 lần (mẫu vật mô phân sinh) với sự phân bố giai thừa của ba nồng độ SA (0, 0.5 và 1 mM) và ba nồng độ NaCl (0, 175 và 200 mM). Các thông số được sử dụng để đánh giá khả năng chịu mặn in vitro của H. moscheutos (còn gọi là 'Luna Red') và H. acetosella bao gồm chiều cao chồi và số chồi, sự hình thành rễ được thể hiện bằng phần trăm số lượng mẫu vật có phát triển rễ, hàm lượng proline của cây con tái sinh và tỉ lệ sống sót. Chiều cao chồi được đo tại 10, 20, và 30 ngày sau khi chuyển cây vào trong ống nghiệm, và số lượng chồi nhân lên thêm được tính vào ngày thứ 30. Sự hình thành rễ và chiều dài rễ được ghi lại ở 60 ngày sau khi bắt đầu nuôi cấy. Tỷ lệ sống sót, cả trong ống nghiệm và ex vitro, được đánh giá ở 90 ngày sau khi bắt đầu nuôi cấy. Thí nghiệm được lặp lại ba lần. Dữ liệu được phân tích phương sai (ANOVA) vàgiá trị trung bình của các thử nghiệm đã được tách ra bằng cách sử dụng test Tukey HSD ở P = 5%. Tất cả các phân tích dữ liệu được thực hiện bằng phần mềm phân tích thống kê SAS (SAS Institute, 2003).
KẾT QUẢ VÀ THẢO LUẬN
Sự phát triển của cây
Phản ứng tăng trưởng của hai loài Hibiscus, được đo bằng chiều cao và số chồi, được tóm tắt trong Bảng 1. Đối với H. moscheutos, việc bổ sung 0.5 mM SA cải thiện sự tăng trưởng của chồi so với mẫu đối chứng (0 mM NaCl) và sản sinh nhiều chồi hơn trong môi trường không có muối (Bảng 1).
Bảng 1. Ảnh hưởng của nồng độ khác nhau của salicylic acid (SA) và natri clorua (NaCl) lên chiều cao cây (± SE) và số lượng trung bình (± SE) của chồi trên các mẫu vật mô phân sinh nuôi cấy in vitro từ H. moscheutos ('Luna Red ') và H. acetosella.
|
H. moscheutos |
|
Chiều cao chồi (cm) |
|
|
SA (mM) |
NaCl (mM) |
Ngày thứ 10 |
Ngày thứ 20 |
Ngày thứ 30 |
Số lượng chồi/mẫu vật |
|
0 |
0 |
3.7 ± 0.4b |
8.1 ± 0.3b |
11.5 ± 2.1b |
2.7 ± 0.3b |
|
0.5 |
0 |
4.7 ± 0.1a |
10.1 ± 0.5a |
14.1 ± 1.1a |
5.7 ± 1.1a |
|
1 |
0 |
3.3 ± 1.3b |
7.8 ± 1.9b |
10.6 ± 2.3b |
2.5 ± 1.2b |
|
0 |
175 |
2.6 ± 0.5b |
5.5 ± 0.1b |
5.9 ± 3.2c |
2.1 ± 0.1 b |
|
0.5 |
175 |
3.3 ± 0.1a |
7.3 ± 1.3a |
9.5 ± 1.4a |
3.0 ± 0.5a |
|
1 |
175 |
3.1 ± 0.3a |
6.9 ± 2.1a |
7.8 ± 2.4b |
3.1 ± 1.8a |
|
0 |
200 |
1.9 ± 0.2ab |
1.9 ± 0.5b |
2.3 ± 0.3b |
1.0 ± 0.2a |
|
0.5 |
200 |
2.5 ± 1.4a |
3.5 ± 1.5a |
5.4 ± 2.1a |
1.8 ± 0.5 a |
|
1 |
200 |
2.1 ± 1.1ab |
2.9 ± 1.3a |
4.2 ± 1.7a |
1.0 ± 0.1 a |
|
H. acetosella |
|
0 |
0 |
4.6 ± 0.2a |
6.1 ± 0.2b |
8.5 ± 1.1b |
3.7 ± 0.3b |
|
0.5 |
0 |
4.6 ± 0.1a |
8.1 ± 0.1a |
12.1 ± 1.1a |
6.1 ± 0.1a |
|
1 |
0 |
4.3 ± 1.3a |
5.8 ± 1.9b |
7.6 ± 2.4b |
3.2 ± 0.6b |
|
0 |
175 |
2.1 ± 0.5a |
2.5 ± 1.1b |
3.0 ± 1.1b |
1.3 ± 1.1ab |
|
0.5 |
175 |
2.2 ± 1.1a |
3.3 ± 1.1a |
4.6 ± 1.2a |
2.0 ± 0.5a |
|
1 |
175 |
1.9 ± 2.3a |
3.4 ± 0.1a |
4.8 ± 2.4a |
1.4 ± 1.8ab |
|
0 |
200 |
1.2 ± 0.1b |
1.5 ± 1.1b |
1.8 ± 0.3b |
1.0 ± 0.2a |
|
0.5 |
200 |
2.0± 1.1a |
3.1 ± 1.3a |
3.9 ± 1.9.a |
1.1 ± 0.5 a |
|
1 |
200 |
1.9 ± 1.1a |
2.8 ± 1.3a |
3.2 ± 1.8a |
1.0 ± 0.1 a |
Các giá trị trung bình có cùng một chữ cái trong cùng một cột và thuộc cùng một phương pháp xử lý NaCl không khác biệt đáng kể khi sử dụng Tukey test (P <0,05). Mỗi giá trị thể hiện giá trị trung bình ± SE. Kết quả là từ 20 lần thực hiện và mỗi nghiệm thức được lặp lại ba lần.
Các kết quả này không đáng ngạc nhiên vì SA là một chất giống như hormone đã được báo cáo để tăng cường tái tạo in vitro ở một số loài thực vật, bao gồm cà phê arabica (Quiroz-Figueroa và cộng sự, 2001), đậu ván dầu adsurgen (Luo và cộng sự, 2001 ), và yến mạch nuda (Hao và cộng sự, 2006). Ngoài ra, bổ sung 0.5 hoặc 1 mM SA vào môi trường chứa 175 mM NaCl cải thiện đáng kể cả tăng trưởng và nhân giống so với nghiệm thức đối chứng (0 mM SA) đối với H. moscheutos (Bảng 1). Mặt khác, việc đưa 0.5 hoặc 1 mM SA vào chế độ NaCl 200 mM đã cải thiện đáng kể sự tăng trưởng của chồi nhưng không nhân chồi (Bảng 1) trong cùng một loài. Đối với H. acetosella, việc đưa 0.5 mM SA vào môi trường không có muối cải thiện cả sự tăng trưởng của thân chồi và nhân giống (Bảng 1). Tuy nhiên, không có sự khác biệt đáng kể giữa 0 mM SA và 1 mM SA. Các giá trị thấp ở chiều cao chồi và số lượng chồi có thể là do ảnh hưởng độc hại của SA đã được báo cáo ở một số loài thực vật ở nồng độ cao hơn (Roustan và cộng sự, 1989). Trong thí nghiệm có khi H. acetosella phải chịu NaCl tới 175 mM, đây là sự khác biệt đáng kể giữa môi trường chứa SA và môi trường đối chứng (0 mM SA) cho thử nghiệm sự phát triển của chồi (Bảng 1). Có sự giảm chiều cao và số lượng chồi khi cácmẫu vật được cấy trong môi trường chứa 200 mM NaCl, mặc dù các mẫu vật được nuôi cấy trong môi trường chứa SA có hiệu quả tốt hơn so với nghiệm thức đối chứng (0 mM SA) đối với chiều cao chồi. Không có sự khác biệt đáng kể về số lượng chồi giữa các nghiệm thức trong tình huống này. Hiệu quả cải thiện của khi sử dụng SA ngoại sinh trên sự tăng trưởng in vitro trong môi trường nước muối và không có muối đã được quan sát cho cả hai loài. Nhìn chung, hiệu quả này đã được phát hiện rõ ràng hơn ở 0.5 mM SA. Các kết quả thu được trong nghiên cứu này phù hợp với các phát hiện khác ở cây trồng khác nhau của một số tác giả (Zhou và cộng sự, 1999, Tari và cộng sự, 2002, Shakirova và cộng sự, 2003. Arfan và cộng sự, 2007) cho biết rằng SA thúc đẩy tăng trưởng và chống lại sự ức chế tăng trưởng gây ra bởi các stress phi sinh học.
Tạo rễ và tăng trưởng
Ở H. moscheutos, không có sự khác biệt giữa các mẫu vật phát triển trong môi trường không có muối để tạo rễ và tăng trưởng (Hình 1). Cả tỷ lệ cây ra rễ và sự tăng trưởng tiếp theo của rễ đều bị ảnh hưởng xấu bởi việc đưa NaCl vào trong môi trường nuôi cấy, nhưng tác động tiêu cực này đã được làm giảm đáng kể bằng cách kết hợp SA vào các nghiệm thức khác nhau (Hình 1B và D). Ví dụ, trong môi trường chứa 0.5 mM SA và 175 mM NaCl, tỷ lệ chồi ra rễ và chiều dài rễ trung bình lần lượt cao gấp 3.6 lần và 5.3 lần so với cấy trên môi trường có 175 mM NaCl không có SA (hình 1B và D). Đối với môi trường chứa 200 mM NaCl và 0 mM SA, chỉ có 4.9% số cành được hình thành, và chiều dài rễ trung bình giảm nghiêm trọng. Trong môi trường không có muố, 80% các mẫu vật H. acetosella cấy in vitro đều phát triển rễ với chiều dài rễ trung bình khoảng 3 cm (Hình 1A và C). Tuy nhiên, sự hình thành rễ và sự phát triển của rễ hoặc chiều dài rễ của H. acetosella bị ảnh hưởng tiêu cực bởi NaCl hơn so với H. moscheutos, cho thấy rằng H. moscheutos có thể chịu được mặn hơn. Những tác dụng bất lợi này được phát hiện rõ rệt hơn khi nồng độ muối tăng lên 200 mM. Tuy nhiên, cho dù có nồng độ muối cao như thế này, thì việc đưa SA vào môi trường đã cải thiện sự hình thành rễ, so với các nghiệm thức không chứa SA (Hình 1A). Hiệu quả tích cực của SA đối với sự hình thành và tăng trưởng của rễ là mối quan tâm đặc biệt, vì một số báo cáo về các nghiên cứu khả năng chịu mặn in vitro cho thấy rằng sự hình thành và phát triển của rễ không chỉ bị ảnh hưởng đến muối mà còn tương quan với khả năng chịu mặn ở cả cây trồng (Martinez et al, 1996, Cano và cộng sự, 1998). Hơn nữa, sử dụng SA ngoại sinh tác động qua rễ đã tạo ra khả năng chống chịu đối với các stress phi sinh học bao gồm khả năng chịu nhôm của cây Muồng ngủ (Cassia tora) (Yang và cộng sự, 2003), chịu cadmium của lúa (Guo và cộng sự, 2007) và chịu mặn của lúa mì (Arfan và cộng sự, 2007).
Tỉ lệ sống sót
Khi chồi H. moscheutos được nuôi cấy trong môi trường không có muối, tỷ lệ sống sót rất cao, dao động từ 93.5 đến 96.3% trong môi trường chứa 1 và 0 mM SA, tương ứng (Hình 2B). Tỷ lệ sống sót này đã giảm xuống khoảng 48% trong môi trường chứa 175 mM NaCl và không có SA. Tuy nhiên, việc đưa SA vào các môi trường chứa nồng độ muối này đã làm tăng tỷ lệ sống sót của cây tới trên 70%. Khi nồng độ muối tăng lên 200 mM, tỉ lệ sống sót của cây đã giảm xuống 12.3% đối với môi trường không chứa SA và 52.0% với nồng độ 0.5 mM và 38.7% với 1 mM SA (Hình 2B). Đối với mẫu vật của H. acetosella phát triển ở môi trường không có muối, tỷ lệ sống sót (94.1 - 97.0%) tương đương với tỷ lệ sống sót của H. moscheutos được nuôi trong điều kiện giống hệt nhau (Hình 2A). Dưới điều kiện mặn (175 mM NaCl), tỷ lệ sống sót của H. acetosella giảm mạnh, đặc biệt khi các chồi non nuôi trong điều kiện không chứa SA. Tuy nhiên, khi 0.5 hoặc 1 mM SA đã được thêm vào môi trường tăng trưởng, một sự cải thiện đáng kể đã được quan sát thấy khi tỷ lệ sống sót tăng lên khoảng 50% (Hình 2A). Khi độ mặn tăng lên 200 mM, tỷ lệ sống sót giảm đáng kể, thể hiện qua tổng tỷ lệ chết đối với chồi phát triển trong môi trường không có SA. Tỷ lệ chết giảm nhẹ khi chồi tiếp xúc với môi trường có 200 mM NaCl có 0.5 mM hoặc 1 mM SA. Dựa trên phản ứng tổng thể của hai loài Hibiscus, có thể kết luận rằng H. moscheutos là một loài có khả năng chịu mặn cao hơn H. acetosella. Việc sử dụng SA đã cải thiện sự phát triển của cây, sự hình thành và sự phát triển của rễ và tỷ lệ sống của cả hai loài này trong cả hai môi trường nhiễm mặn và không nhiễm mặn.
Hàm lượng Proline
Trong môi trường có hàm lượng muối cao, cây trồng duy trì hàm lượng nước bằng cách tích tụ các chất hữu cơ tương thích như proline, trong tế bào chất (Harinasut và cộng sự, 2000). Các chất hữu cơ tan này hoạt động như chất điều tiết áp suất thẩm thấu trong phản ứng đối với stress phi sinh học, như độ mặn tăng. Sự tích tụ Proline dưới áp lực muối đã được báo cáo và gợi ý là một chất đánh dấu sinh hóa để tăng khả năng chịu mặn của các loài thực vật như khoai tây (Martinez và cộng sự, 1996), dâu tằm (Harinasut và cộng sự, 2000), cây keo (Yokota, 2003), và mía (Gandonou và cộng sự, 2006). Trong nghiên cứu này, hàm lượng proline tự do trong chồi non của H. moscheutos tăng khi độ mặn tăng lên 175 mM (Hình 2). Mức tăng này cao hơn đáng kể khi SA (0.5 hoặc 1 mM) được thêm vào môi trường nuôi cấy. Tuy nhiên, khi nồng độ muối tăng lên đến 200 mM, có sự giảm nhẹ hàm lượng proline (hình 2). Đối với H. acetosella, hàm lượng proline của chồi trong môi trường không mặn thấp hơn so với H. moscheutos được nuôi cấy trong cùng điều kiện (Hình 2C và D). Thêm vào đó, như trường hợp của H. moscheutos, hàm lượng proline của H. acetosella trong điều kiện chịu mặn tăng lên đáng kể (Hình 2A). Sự tích lũy prolin trong H. acetosella được thấy rõ hơn trong các nghiệm thức có chứa NaCl và SA, mặc dù sự tích tụ proline tổng thể ở H. moscheutos cao hơn so với H. acetosella (ít loài có khả năng chịu mặn hơn). Những kết quả này phù hợp với những báo cáo của Igarashi và cộng sự (1997), người đã phát hiện ra rằng trong điều kiện độ mặn cao, các giống lúa chịu mặn cao có mức độ tích lũy proline cao hơn so với các loài nhạy cảm với độ mặn. Tuy nhiên, các nhà nghiên cứu khác đã báo cáo rằng proline tích tụ một lượng lớn hơn trong cây nhạy cảm với độ măn so với những cây có khả năng chịu mặn (Liu và Zhu, 1997; Yokota, 2003). Trong nghiên cứu này, mức độ tích lũy prolin dường như liên quan đến mức độ dung nạp muối, bởi vì sự tích lũy proline nhiều hơn xảy ra ở nhiều loài chịu mặn, H. moscheutos, dưới điều kiện không có muối và độ muối cao (Hình 2C và D). Kết luận, các kết quả thu được cho thấy rằng SA cải thiện tái sinh chồi và khả năng chịu mặn trong điều kiện in vitro đối với hai loài Hibiscus nghiên cứu. Sự cải thiện khả năng chịu mặn của H. acetosella được xử lý với SA khẳng định rằng tất cả các loài thực vật, bao gồm cả các loài nhạy cảm, đều có gen trong bộ gen của chúng để dung nạp muối (Zhu, 2000), do đó các phương pháp in vitro được phát triển ở đây sử dụng các cây trồng được xử lý với SA có thể là một công cụ có giá trị trong các nghiên cứu biểu hiện gen để so sánh các cây trồng chịu mặn và cây nhạy cảm với độ mặn.
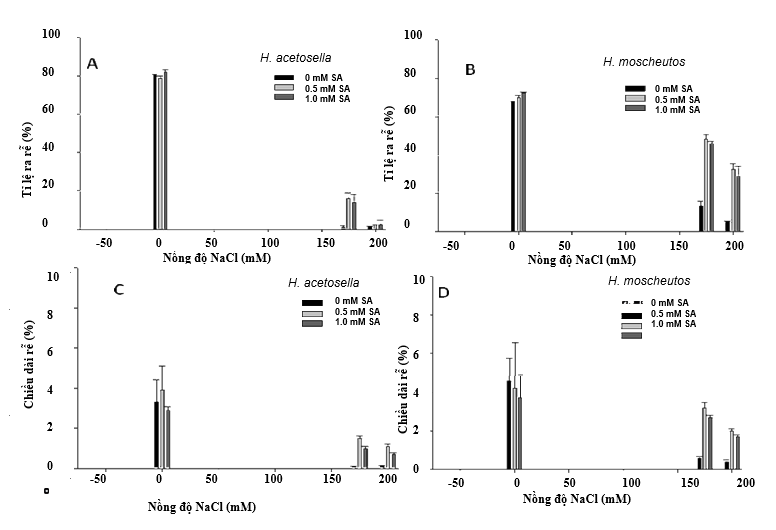
Hình 1. Ảnh hưởng của salicylic acid (SA) và natri clorua (NaCl) lên sự hình thành rễ in vitro (A và B) và tăng trưởng (C và D) của hai loài Hibiscus, H. moscheutos và H. acetosella (B). Mỗi giá trị đại diện cho giá trị trung bình ± SE. Kết quả là từ 20 lần lặp lại (mẫu vật mô phân sinh ngọn) và mỗi thử nghiệm được lặp lại ba lần.
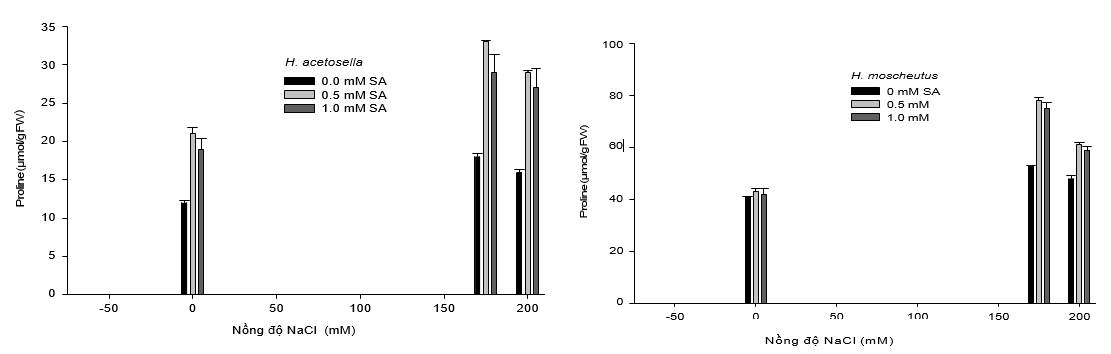
Hình 2. Ảnh hưởng của salicylic acid (SA) và natri clorua (NaCl) đối với sự sống sót chồi nuôi in vitro (A và B) và hàm lượng proline (C và D) của hai loài Hibiscus, H. moscheutos và H. acetosella. Mỗi giá trị đại diện cho giá trị trung bình ± SE. Kết quả là từ 20 lần lặp lại (mẫu vật mô phân sinh ngọn) và mỗi thử nghiệm được lặp lại ba lần.
Những kết quả này cũng gợi ý rằng phương pháp mô tả trong nghiên cứu này có thể đưa vào một chương trình nhân giống để kiểm tra và phát triển nhanh các cây Hibiscus chịu mặn. Những cây có khả năng chịu mặn được xác định có thể được nhân giống vô tính bằng cách sử dụng mô hình nuôi cấy in vitro được mô tả ở đây hoặc thông qua các cành giâm để đánh giá thêm trong nhà kính hoặc ngoài đồng ruộng. Cuối cùng, phương pháp nuôi cấy mô được cải thiện bằng cách sử dụng các nồng độ SA khác nhau có thể tạo thành một công cụ nhân giống hiệu quả cho cả H.acetosella và H. moscheutos.
LỜI CẢM ƠN
Nhóm tác giả gửi lời cảm ơn đến Kermis Myrick, Alexandria Goins, Lindsey Tanguis, và Tigest Boutwell đã hỗ trợ kỹ thuật.
Lời khước từ
Việc đề cập đến nhãn hiệu hoặc sản phẩm độc quyền không được đảm bảo hay bảo hành sản phẩm bởi Bộ Nông nghiệp Hoa Kỳ và không ngụ ý chấp thuận đối với việc loại trừ các sản phẩm khác cũng có thể phù hợp.
TÀI LIỆU THAM KHẢO
Arfan M, Athar HR, Ashraf M (2007). Does exogenous application of salicylic acid through the rooting medium modulate growth and photosynthetic capacity in two differently adapted spring wheat cultivars under salt stress? J. Plant Physiol. 164: 685-694.
Bates LS, Waldren RP, Teare ID (1973). Rapid determination of free proline for water-stress studies. Plant and Soil 39: 205-207.
Cano EA, Perez-Alfocea F, Moreno V, Caro M, Bolarin MC (1998). Evaluation of salt tolerance in cultivated and wild tomato species through in vitro shoot apex culture. Plant Cell Tissue Organ. Cult. 53: 19-26.
Dat JF, Foyer CH, Scott IM (1998). Changes in salicylic acid and antioxidants during induced thermotolerance in mustard seedlings. Plant Physiol. 118: 1455-1461.
Eraslan F, Inal A, Gunes A, Alpaslan M (2007). Impact of exogenous salicylic acid on the growth, antioxidant activity and physiology of carrot plants subjected to combined salinity and boron toxicity. Sci. Hortic. 113: 120-128.
Foolad MR, Jones RA (1993). Mapping salt-tolerance genes in tomato (Lycopersicon esculentum) using trait-based markers analysis. Theor. Appl. Genet. 87: 184-192.
Gamborg OL, Miller RA, Ojima K (1968). Nutrient requirements of sus- pension cultures of soybean root cells. Exp. Cell Res. 50: 151-158.
Gandonou CB, Errabii T, Abrini J, Idaomar M, Senhaji NS (2006). Selection of callus cultures of sugarcane (Saccharum sp.) tolerant to NaCl and their response to salt stress. Plant Cell Tissue Organ Cult. 87: 9-16.
Ghosal SS, Bajaj YPS (1984). Isolation of sodium chloride resistant cell lines in some grain legumes. Indian J. Exp. Biol. 22: 209-214.
Gunes A, Inal A, Alpaslan M, Eraslan F, Bagci EG, Cicek N (2007). Salicylic acid induced changes on some physiological parameters symptomatic for oxidative stress and mineral nutrition in maize (Zea mays L.) grown under salinity. J. Plant Physiol. 164: 728-736.
Guo B, Yongchao L, Zhaojun L, Wei G (2007). Role of salicylic acid in alleviating cadmium toxicity in rice roots. J. Plant Nutr. 30: 427-439.
Hao L, Zhou L, Xu X, Cao J, Xi T (2006). The role of salicylic acid and carrot embryogenic callus extracts in somatic embryogenesis of naked oat (Avena nuda). Plant Cell, Tissue Organ Cult. 85: 109-113. Harinasut P, Srisunak S, Pitukchaisopol S, Charoensataporn R (2000). Mechanisms of adaptations to increasing salinity of mulberry: Proline content and ascorbate peroxidase activity in leaves of multiple
shoots. Science Asia. 26: 207-211.
Horváth E, Szalai G, Janda T (2007). Induction of abiotic stress tolerance by salicylic acid signaling. J. Plant Growth Regul. 26: 290- 300.
Igarashi Y, Yoshiba Y, Sanada Y, Yamaguchi-Shinozaki K, Wada K, Shinozaki K (1997). Characterization of gene for Al-pyrroline-5- carboxylate synthetase and correlation between the expression of gene and salt tolerance in Oriz sativa L. Plant Mol. Biol. 33: 857-865. Janda T, Szalai G, Tari I, Páldi E (1999). Hydroponic treatment with salicylic acid decreases the effect of chilling injury in maize (Zea
mays L.) plants. Planta 208: 175-180.
Kusumi K, Yaeno T, Kojo K, Hirayama M, Hirokawa D (2006). The role of salicylic acid in the glutathione-mediated protection against photooxidative in rice. Physiol. Plant. 128: 651-661.
Liu J, Zhu J-K (1997). Proline accumulation and salt-stressed-induced gene expression in a salt-hypersensitve mutant of Arabiodopsis. Plant Physiol. 114: 591-596.
Luo J-P, Jiang S-T, Pan L-J (2001). Enhanced somatic embryogenesis by salicylic acid of Astragalus adsurgens Pall.: relationship with H2O2 production and H2O2-metabolizing enzyme activities. Plant Sci. 161: 125-132.
Malamy J, Carr JP, Klessig DF, Raskin I (1990). Salicylic acid: A likely endogenous signal in the resistance response of tobacco to viral infection. Sci. 250: 1001-1004.
Martinez CA, Maestri M, Lani EG (1996). In vitro salt tolerance and proline accumulation in Andean potato (Solanum spp.) differing in frost resistance. Plant Sci. 116: 177-184.
Menzel MY, Wilson FD (1961). Chromosomes and crossing behavior of Hibiscus cannabinus, H. acetosella, and H. radiatus. Am. J. Bot. 48:551-650.
Métraux JP, Signer H, Ryals J, Ward E, Wyss-Benz M, Gaudin J, Raschdorf K, Schmid E, Blum W, Inverardi B (1990). Increase in salicylic acid at the onset of systemic acquired resistance in cucumber. Science 250: 1004-1006.
Mora-Herrera ME, Lopez-Delgado H, Castillo-Morales A, Foyer CH (2005). Salicylic acid and H2O2 function by independent pathways in the induction of freezing tolerance in potato. Physiol. Plant. 125: 430-440.
Murashige T, Skoog F (1962). A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol. Plant. 15: 473-497.
Quiroz-Figueroa F, Mendez-Zeel M (2001). Picomolar concentration of salicylates induce cellular growth and enhance somatic embryo- genesis in Coffea arabica tissue culture. Plant Cell Rep. 20: 679-689. Raskin I (1992). Role of salicylic acid in plants. Ann. Rev. Plant Physiol.Mol. Biol. 43: 439-463.
Roustan JP, Latche A, Fallot J (1989). Stimulation of Daucus carota somatic embryogenesis by inhibitors of ethylene synthesis cobalt and nickel. Plant Cell Rep. 8, 182-185.
SAS Institute. 2003. SAS STAT 9.1. SAS Inst., Cary, NC, USA.
Shakirova FM, Sakhabutdinova AR, Bezrukova MV, Fatkhutdinova RA, Fatkhutdinova DR (2003). Changes in the hormonal status of wheat seedlings induced by salicylic acid and salinity. Plant Sci 164: 317- 322.
Stevens J, Senaratna T, Sivasithamparam K (2006). Salicylic acid induces salinity tolerance in tomato (Lycopersicon esculentum cv. Roma): associated changes in gas exchange, water relations and membrane stabilization. Plant Growth Rgul. 49: 77-83.
Strobel NE, Kuc A (1995). Chemical and biological inducers of systemic acquired resistance to pathogens protect cucumber and tobacco from damage caused by paraquat and cupric Chloride. Phytopathology 85:1306-1310.
Tari I, Csiszar J, Szalai G, Horvath F, Pecsvaradi A, Kiss G, Szepesi A, Szabo M, Erdei L (2002). Acclimation of tomato plants to salinity stress after a salicylic acid pre-treatment. Acta Biol. Szeged 46: 55- 56.
Vijayan K, Chakraborti SP, Ghosh PD (2003). In vitro screening of mul- berry (Morus spp.) for salinity tolerance. Plant Cell Rep. 22: 350-357.
Winicov I (1998). New molecular approaches to improving salt tolerance in crop plants. Annals of Bot. 82: 703-710.
Yang ZM, Wang J, Wang SH, Xu LL (2003). Salicylic acid-induced aluminum tolerance by modulation of citrate efflux from roots of Cassia tora L. Planta 217: 168-174.
Yokota S (2003). Relationship between salt tolerance and proline accumulation in Australian acacia species. J. For. Res. 8: 89-93.
Zhou X M, MacKenzie AF, Madramootoo CA, Smith DL (1999). Effect of stem-injected plant growth regulators, with or without sucrose, on grain production, biomass and photosynthetic activity of field-grown corn plants. J. Agric. Crop Sci. 183: 103-110.
Zhu J-K (2000). Genetic analysis of plant salt tolerance using Arabidopsis. Plant Physiol. 124: 941-948
Khải Mùi
SBC Scientific