Ảnh hưởng của kháng sinh Kanamycin đối với việc nuôi cấy mô và hình thành phôi sôma ở cây bông vải. Sử dụng kháng sinh cho mục đích chọn lọc chuyển gen. Ngoài ra, kháng sinh còn được dùng để xử lý mẫu mô trước khi đưa vào ống nghiệm.

Các chất kháng sinh aminamoglycoside kanamycin đã được đánh giá về những ảnh hưởng lên sự hình thành mô sẹo từ những mẫu nuôi cấy hypocotyl và lá mầm, sự tăng sinh của mô sẹo không sinh phôi và mô sẹo sinh phôi, sự hình thành và phát triển của phôi somatictic ở cây bông (Gossypium hirsutum L.). Trên cơ sở đó đã đánh giá tiềm năng sử dụng kanamycin như là chất chọn lọc trong chuyển gen với gen neomycin phosphotransferase II như một gen marker chọn lọc. Mẫu nuôi cấy lá mầm và hypocotyl của cây bông, và các mô sẹo phôi hóa rất nhạy cảm với kanamycin. Kanamycin ở nồng độ 10 mg/L hoặc cao hơn làm giảm sự hình thành mô sẹo, và ức chế hoàn toàn ở nồng độ 60 mg/L. Kanamycin ức chế sự phát triển và tăng sinh mô sẹo phôi hóa, cũng như việc sự hình thành và phát triển phôi somatic ở cây bông. Sự nhạy cảm của mô sẹo phôi hóa và phôi somatic với kanamycin là khác nhau trong từng giai đoạn hình thành và phát triển. Kanamycin được xem như một chất chọn lọc thích hợp cho sự hình thành của mô sẹo biến đổi và mô sẹo không phôi. Ở nồng độ từ 40 đến 60 mg/L là nồng độ kanamycin tối ưu cho sự kích thích và tăng sinh của mô sẹo biến đổi. Nồng độ kanamycin phải tăng lên (từ 50 đến 200 mg/L) cho sự chọn lọc của mô sẹo phôi hóa biến đổi gen và phôi somatic. Một mô hình của sự chọn lọc các cây bông biến đổi gen khi sử dụng kanamycin làm chất chọn lọc được nghiên cứu.
Các từ viết tắt:: 2,4-D – 2,4-dichlorophenoxyacetic acid; B5 – Gamborg (1968) medium; Km – kanamycin; LD – lethal dose; MS – Murashige and Skoog (1962) medium; npt II – neomycin phosphotransferase II; ZT – zeatin
1. Giới thiệu
Các aminamoglycoside kanamycin, hoạt động như một tác nhân chọn lọc, thường được sử dụng trong công nghệ di truyền thực vật. Điều này là do kanamycin có thể giết chết tế bào thực vật hoang dã. Trong quá trình chuyển gen thực vật, gen neomycin phosphotransferase II (npt II) là một trong những gen maker chọn lọc thông dụng nhất [13]. Gen npt II mã hoá neomycin phosphotransferase II, mang lại sức đề kháng trên các tế bào chủ với một loạt kháng sinh aminoglycoside như kanamycin (Km), neomycin, geneticin (G418) và paromomycin. Các kháng sinh này ức chế sự phát triển của tế bào thực vật bằng cách liên kết với tiểu đơn vị ribosome 30S, do đó ức sự chuyển đổi của plastid [31, 45]. Các tế bào thực vật chuyển đổi với gen npt II có thể giải độc các kháng sinh trong môi trường chọn lọc [23].
Ở cây bông chúng tôi đã phát triển phôi somatic và hệ thống tái tạo thực vật đáng tin cậy [51-54], và quan tâm đến việc cải tạo cây bông bằng cách chuyển đổi gen. Một trong những yêu cầu để chuyển đổi gen ở cây bông là tác nhân chọn lọc phù hợp để xác định các mô hoặc tế bào chuyển gen bằng Agrobacterium tumefaciens hoặc sau khi bắn các hạt DNA. Các tác nhân chọn lọc phải cho phép tế bào chuyển gen phát triển thành mô sẹo, sau đó tái sinh thành toàn bộ cây, trong khi các tế bào không chuyển gen sẽ bị ức chế hoặc bị giết.
Việc lựa chọn kanamycin cho mô chuyển gen bằng cách sử dụng gen npt II như là một maker chọn lọc được biết đến cho cây bông, và thường được sử dụng trong chuyển gen cây bông [1, 5, 7, 11, 12, 20, 21, 24, 28, 30 , 33, 35, 40, 42, 43, 48-50]. Báo cáo đầu tiên được xuất bản vào những năm 1980 [12, 42, 43], và hệ thống này được sử dụng rộng rãi để sản xuất số lượng lớn cây bông biến đổi gen ở một số phòng thí nghiệm. Do đó, đã có sự tiến bộ lớn trong kỹ thuật di truyền đối với cây bông [1, 5, 7, 11, 12, 20, 21, 24, 28, 30, 33, 35, 40, 42, 43, 48, 50]. Tuy nhiên, hiệu quả của chuyển gen ở cây bông tương đối thấp, có rất nhiều "thất thoát" (không chuyển đổi) trong quần thể cây tái sinh [20, 49]. Lý do của việc này có thể liên quan đến việc sử dụng nồng độ kanamycin không thích hợp để chọn lọc các tế bào chuyển gen, nhưng ảnh hưởng của kanamycin đối với sự hình thành và tăng trưởng của mô sẹo, sự tăng sinh của mô sẹo không phôi và những mô sẹo phôi hóa, và sự biệt hóa phát triển của phôi somatictic chưa được ghi nhận.
Mục tiêu của nghiên cứu này là xác định hiệu quả của kháng sinh kanamycin đối với sự hình thành mô sẹo, sự tăng sinh, sinh phôi somatic và sự phát triển của phôi somatic ở cây bông, và để đánh giá tiềm năng của kanamycin trong việc chọn lọc các tế bào chuyển gen ở các giai đoạn phát triển khác nhau của cây bông.
2. Vật liệu và phương pháp
2.1 Vật liệu thực vật
Hạt giống cây bông (Gossypium hirsutum L.) cv Coker 201 được thu thập từ Viện nghiên cứu cây bông, Học viện Khoa học Nông nghiệp Trung Quốc, Anyang, P.R. Trung Quốc. Hạt nhân đã được lấy ra khỏi hạt và hạt nhân đã trưởng thành được lựa chọn và khử trùng theo quy trình sau: Đầu tiên hạt nhân này được khử trùng bề mặt với 0,1% HgCl2 , sau đó rửa ít nhất ba lần bằng nước cất vô trùng. Các hạt nhân sau đó đã được đặt trên môi trường agar cứng 0,7%, pH 5.8, bao gồm môi trường Murashige và Skoog (MS) 1 nửa các muối vô cơ [32], Gamborg (B5) [15] và sucrose 2% cho sự nảy mầm.
2.2 Kháng sinh Kanamycin
Dung dịch kanamycin gốc (50 mg/ml) được chuẩn bị bằng cách hòa tan kanamycin (Sigma Co., St. Louis) trong nước cất vô trùng và được khử trùng lạnh bằng sử dụng lọc màng ProX 0.22 μm. Dung dịch gốc(Kanamycin) này được thêm vào môi trường nuôi cấy sau khi hấp để nguội (khoảng 40 °C~50 °C).
2.3 Kích thích và duy trì của mô sẹo không phôi và mô sẹo phôi hóa
Các phần hypocotyl (dài 3-5mm) và mẫu lá mầm (diện tích bề mặt 10-16mm2) của cây giống 7 ngày tuổi được đặt trên môi trường có chứa 0.5 mg/L 2,4-D và 0.1 mg/ .L zeatin cho sự kích thích mô sẹo. Sau khoảng 2 tháng những mô sẹo phôi hóa xuất hiện sẽ được phát chuyển sang môi trường mới như ở trên để tăng sinh. Sau đó, mô sẹo phôi hóa được duy trì ở môi trường nuôi cấy lần 2 trong 28 ngày, và mô sẹo không phôi được duy trì ở môi trường nuôi cấy lần 2 trong 20 ngày.
2.4 Ảnh hưởng của kanamycin đối với sự hình thành mô sẹo từ các mẫu mô hypocotyl và mẫu mô lá mầm
Các phần hypocotyl (dài 3-5mm) và mẫu lá mầm (diện tích bề mặt 10-16mm2) của cây giống 7 ngày tuổi được đặt trên môi trường MS được bổ sung 0,5 mg/L 2,4-D, 0,1 mg/L ZT và các nồng độ kanamycin khác nhau (0, 10, 20, 40, 60, 80, 100 và 120 mg/L) (kanamycin được lọc khử trùng và được bổ sung thêm vào môi trường sau khi hấp) để nghiên cứu ảnh hưởng của kanamycin đối với sự hình thành mô sẹo từ các mẫu mô hypocotyl và mẫu mô lá mầm. Một mô hình thí nghiệm hoàn toàn ngẫu nhiên đã được sử dụng. Mỗi thí nghiệm được lặp lại ba lần. Ba lần lặp lại, mỗi lần có 12 mẫu mô hypocotyl hoặc mẫu mô lá mầm, được sử dụng cho mỗi lần nghiên cứu, kể cả kiểm soát, trong mỗi thí nghiệm.
2.5 Ảnh hưởng của kanamycin đối với sự tăng trưởng của mô sẹo không phôi
Các mô sẹo không phôi được kích thích tạo ra bởi các phương pháp trên đã được chọn lọc và chuyển vào môi trường MS được bổ sung 0,5 mg/L 2,4-D, 0,1 mg/L ZT và các nồng độ kanamycin khác nhau (0, 10, 20, 40, 60, 80, 100 và 120 mg/L) để nghiên cứu ảnh hưởng của kanamycin đối với sự tăng trưởng của mô sẹo không phôi. Thí nghiệm được bố trí như một mô hình hoàn toàn ngẫu nhiên với ba lần lặp lại.
2.6 Ảnh hưởng của kanamycin đối với sự tăng trưởng của mô sẹo phôi hóa, sự hình thành và phát triển của phôi somatic
Các mô sẹo phôi hóa được kích thích tạo ra bởi các phương pháp trên đã được chọn lọc và chuyển vào môi trường MS được bổ sung 0,5 mg/L 2,4-D, 0,1 mg/L ZT và các nồng độ kanamycin khác nhau (0, 10, 25, 50, 75, 100, 125 và 150 mg/L) để nghiên cứu ảnh hưởng của kanamycin lên sự tăng trưởng của mô sẹo phôi hóa, sự hình thành và phát triển của phôi somatic. Những thử nghiệm được bố trí như một mô hình thí nghiệm hoàn toàn ngẫu nhiên với ba lần lặp lại.
Tất cả các môi trường được bổ sung 3% (W/V) sucrose, và được làm cứng với 7g/L agar. pH của môi trường được điều chỉnh đến 5,8 trước khi hấp tiệt trùng ở 121 ° C trong 15 phút. Tất cả các mẫu nuôi cấy được ủ ở 28 ± 2 oC với cường độ ánh sáng khoảng 2000 Lux được cung cấp bởi các đèn huỳnh quang trắng mát với thời gian quang hợp 16 giờ.
2.7 Thu thập và phân tích dữ liệu
Tỉ lệ kích thích mô sẹo và tỷ lệ mẫu mô chết được ghi lại 7 ngày một lần sau 9 ngày nuôi cấy. Trọng lượng tươi của mô sẹo được ghi lại 7 ngày một lần sau 9 ngày nuôi cấy ở mô sẹo không phôi hoặc sau 11 ngày nuôi cấy ở mô sẹo phôi hóa. Các mô sẹo từ tất cả các thử nghiệm đã được đánh giá riêng lẻ, và chỉ số tăng trưởng của mô sẹo được tính theo công thức:
(chỉ số tăng trưởng) = (trọng lượng tươi của mô sẹo sau khi nuôi một số ngày) / (trọng lượng tươi ban đầu của mô sẹo).
Đối với mỗi lần thử nghiệm, 5 mẫu được ghi lại và tính trung bình cho mỗi lần. Sau khi nuôi cấy trong 30 ngày, tổng số phôi somatic trên mỗi gram mô sẹo tươi và số lượng phôi ở mỗi giai đoạn phát triển được ghi lại. Dữ liệu từ ba thí nghiệm riêng biệt được kết hợp bởi vì sự khác nhau giữa các thí nghiệm không đáng kể.
Thử nghiệm được bố trí như một mô hình hoàn chỉnh ngẫu nhiên với 5 lần lặp lại và lặp lại ba lần tương ứng. Dữ liệu được phân tích sử dụng chương trình SAS phiên bản 6.11 (SAS Institute, Cary, N.C.). Mức xác suất 5% (= 0,05) được chọn cho tất cả các kết luận thống kê. Việc phân tích độ sai lệch và phương pháp khác biệt nhỏ nhất có ý nghĩa (LSD) đã được sử dụng để phát hiện sự khác biệt giữa các thí nghiệm.
3. Kết quả
3.1 Ảnh hưởng của kanamycin đối với sự kích thích mô sẹo từ các mẫu mô hypocotyl và mẫu mô lá mầm
Kanamycin trì hoãn sự bắt đầu hình thành mô sẹo, và ức chế sự kích thích tạo ra mô sẹo từ các mẫu mô hypocotyl và mẫu mô lá mầm (hình 1-4). Trên môi trường không có kanamycin, các dấu hiệu ban đầu cho thấy sự xuất hiện của mô sẹo sau 3 ngày nuôi cấy, và sự kích thích mô sẹo tần số cao được quan sát thấy ở 10 ngày nuôi cấy. Trên môi trường có bổ sung kanamycin, mô sẹo bắt đầu hình thành sau 9 ngày nuôi cấy, và xuất hiện nhanh chóng sau 15 ngày nuôi cấy đối với mẫu mô hypocotyl, và sau 20 ngày nuôi cấy đối với mẫu mô lá mầm.
Tỷ lệ hình thành mô sẹo (số lượng các mẫu mô tạo thành mô sẹo / tổng số mẫu mô đã ủ) không bị ảnh hưởng bởi kanamycin ở nồng độ 10 mg/L, đã bị ức chế một phần ở nồng độ từ 20 đến 40 mg/L và đã bị ức chế hoàn toàn ở nồng độ 60 mg/L hoặc ở nồng độ cao hơn (Hình 1 và 3). Mặc dù các mẫu mô hypocotyl và mẫu mô lá mầm được kích thích để hình thành mô sẹo trong môi trường có bổ sung kanamycin với nồng độ thấp (10 đến 40 mg/L), hầu hết các mô sẹo không thể phát triển thêm nữa, bị hóa nâu và chết sau 7 đến 10 ngày nuôi cấy. Trên môi trường bổ sung kanamycin với nồng độ 20 hoặc 40 mg/L , tất cả các mô sẹo được hình thành từ các mẫu mô nuôi cấy đã bị hóa nâu và chết trong vòng 10 ngày. Vì vậy, có rất ít mô sẹo thu được từ các mẫu mô nuôi cấy trên bất kỳ môi trường có bổ sung với kanamycin, mặc dù có một vài mô sẹo được hình thành ở nồng độ kanamycin thấp hơn.
Các mẫu mô hypocotyl trên môi trường chứa từ 40 đến 120 mg/L kanamycin và các mẫu mô lá mầm trên môi trường chứa từ 20 đến 120 mg/L kanamycin biến thành màu trắng và bắt đầu chết sau 16 ngày nuôi cấy đối với mẫu mô hypocotyl và sau 30 ngày nuôi đối với mẫu mô lá mầm (hình 2 và 4). Độ nhạy của các mẫu mô nuôi cấy với kanamycin được đo bằng nồng độ kanamycin gây ra 50% (liều nửa chết, LD50), 90% (LD90) và 100% (liều chết hoàn toàn, LD100). LD50, LD90 và LD100 của kanamycin lần lượt là < 60, 80 và 120 mg/L đối với mẫu mô hypocotyl sau 58 ngày nuôi cấy. LD50 của kanamycin nằm trong khoảng từ 40 đến 60 mg/L đối với mẫu mô lá mầm sau 58 ngày nuôi cấy. LD90 của kanamycin dao động từ 100 đến 120 mg/L đối với mẫu mô hypocotyl sau 58 ngày nuôi cấy. Ảnh hưởng của kanamycin lên sự hình thành mô sẹo được đo bằng sự ức chế kích thích. Hình 1 và 3 cho thấy 60-80 mg/L kanamycin và 10-20 mg/L kanamycin gây ra 50% sự ức chế kích thích mô sẹo sau 30 ngày nuôi cấy. Kanamycin ở liều 60 mg/L dẫn đến ức chế 100% sự kích thích hình thành mô sẹo đối với các mẫu mô hypocotyl và mẫu mô lá mầm sau 30 ngày nuôi cấy.
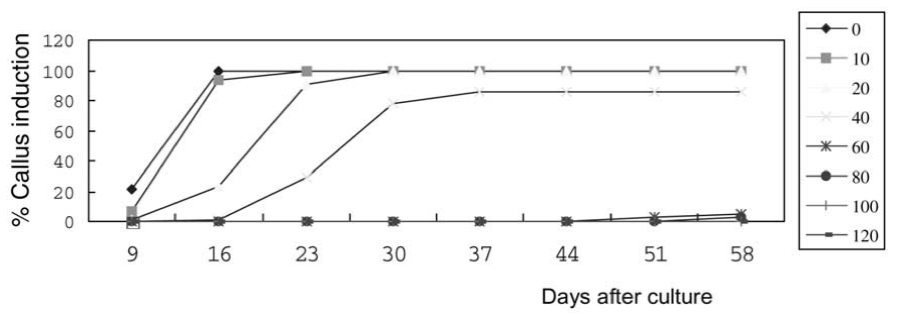
Hình 1. Tần suất kích thích mô sẹo từ các mẫu mô hypocotyl trên môi trường có bổ sung các nồng độ kanamycin khác nhau
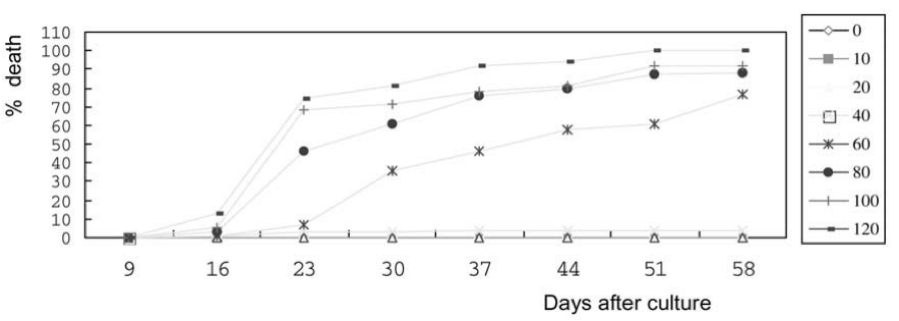
Hình 2. Ảnh hưởng của các nồng độ kanamycin khác nhau đối với tần số gây chết các mẫu mô hypocotyl
Hình 3. Tần suất kích thích mô sẹo từ các mẫu mô lá mầm trên môi trường có bổ sung các nồng độ kanamycin khác nhau
Hình 4. Ảnh hưởng của các nồng độ kanamycin khác nhau đối với tần số gây chết các mẫu mô lá mầm. Nồng độ Kanamycin tương ứng là 0, 10, 20, 40, 60, 80, 100, 120 mg/L
Độ nhạy của các mẫu mô hypocotyl và mẫu mô lá mầm với kanamycin là khác nhau. Các mẫu mô lá mầm ít nhạy hơn đối với kanamycin so với các mẫu mô hypocotyl với sự hình thành mô sẹo, nhưng các mẫu mô hypocotyl nhạy hơn với kanamycin so với mẫu mô lá mầm trong việc duy trì khả năng sống sót (Hình 1-4). Trên môi trường bổ sung 40 mg/L kanamycin, 86% và 4% các mẫu mô hypocotyl hình thành mô sẹo và chết sau 58 ngày nuôi (Hình 2). Ngược lại, trên cùng một môi trường, sau 58 ngày nuôi cấy, chỉ có 7% mẩu mô lá mầm hình thành mo sẹo, nhưng 44% mẫu mô lá mầm đã chết (Hình 4).
3.2 Ảnh hưởng của kanamycin đối với sự tăng trưởng của mô sẹo không phôi
Sự phát triển và tăng sinh của mô sẹo không phôi ở cây bông bị ức chế một phần bởi kanamycin ở nồng độ thấp (10 đến 25 mg/L), và gần như bị ức chế hoàn toàn ở nồng độ 50 mg/L hoặc cao hơn (Hình 5 và 6). Trên môi trường bổ sung kanamycin, hầu hết các mô sẹo không phôi hóa nâu sau 3 ngày nuôi cấy và chết sau 1 tuần nuôi cấy.
Độ nhạy cảm của mô sẹo không phôi ở cây bông lên kanamycin được đo bằng nồng độ kanamycin gây ức chế tăng trưởng 90% (I90) của mô sẹo ở 32 ngày nuôi cấy. Mức ức chế tăng trưởng I90 trong thí nghiệm này là 10 mg/L kanamycin. Điều này chỉ ra rằng mô sẹo không phôi có độ nhạy cao với kanamycin, và ở nồng độ kanamycin thấp (10 mg/L) có thể giết chết hoặc ức chế hơn 90% sự tăng trưởng mô sẹo không phôi. Do đó, trong suốt quá trình chuyển gen của mô sẹo không phôi, ở nồng độ kanamycin 10 mg/L có thể chọn lọc tế bào chuyển gen.
Tuy nhiên, sau 30 ngày nuôi cấy, những mô sẹo ở môi trường 10 hoặc 25 mg/L kanamycin bắt đầu phát triển (Hình 5 và 6). Điều này chỉ ra rằng kanamycin trong môi trường có thể bị phân hủy vào thời điểm này.
3.3 Ảnh hưởng của kanamycin đối với sự tăng trưởng của mô sẹo phôi hóa
Mô seo phôi hóa của cây bông ít nhạy cảm hơn với kanamycin so với các mẫu mô hoặc mô sẹo không phôi (Hình 7 và Hình 8). Nhìn chung, tốc độ tăng trưởng của mô sẹo phôi hóa giảm dần với sự gia tăng nồng độ kanamycin. Độ nhạy cảm của mô sẹo phôi hóa với kanamycin cũng được đo bằng các nồng độ kanamycin gây ra sự ức chế tăng trưởng 50% và 90% (I50, I90) ở 30 ngày nuôi cấy. Nồng độ kanamycin, gây ức chế tăng trưởng I50 là khoảng 50 mg/L. Nồng độ cao nhất của kanamycin được sử dụng trong thí nghiệm này không gây ra sự ức chế tăng trưởng 90% (I90) của mô sẹo phôi hóa. Điều này có nghĩa là kháng sinh kanamycin không thể ức chế hoàn toàn sự tăng trường của mô sẹo phôi hóa cây bông. Nồng độ kanamycin 150 mg/L ức chế chỉ khoảng 80% sự tăng trưởng của mô sẹo phôi hóa ở cây bông. Ở nồng độ này, kanamycin ức chế hoàn toàn sự hình thành, tăng trưởng, và tăng sinh của mô sẹo không phôi, tẩy trắng các mẫu mô hypocotyl và mẫu mô lá mầm, và làm các mô sẹo không phôi hóa nâu và chết. Như vậy, để trở thành một tác nhân chọn lọc trong sự tăng sinh của mô sẹo phôi hóa thì nồng độ kanamycin phải tăng lên.
Để kiểm tra hoạt tính của kanamycin trong môi trường nuôi cấy, tốc độ phát triển của mô sẹo không phôi và mô sẹo phôi hóa được đo mỗi 7 ngày. Kết quả cho thấy kanamycin hiệu quả sau 30-40 ngày nuôi cấy (Hình 5-8).
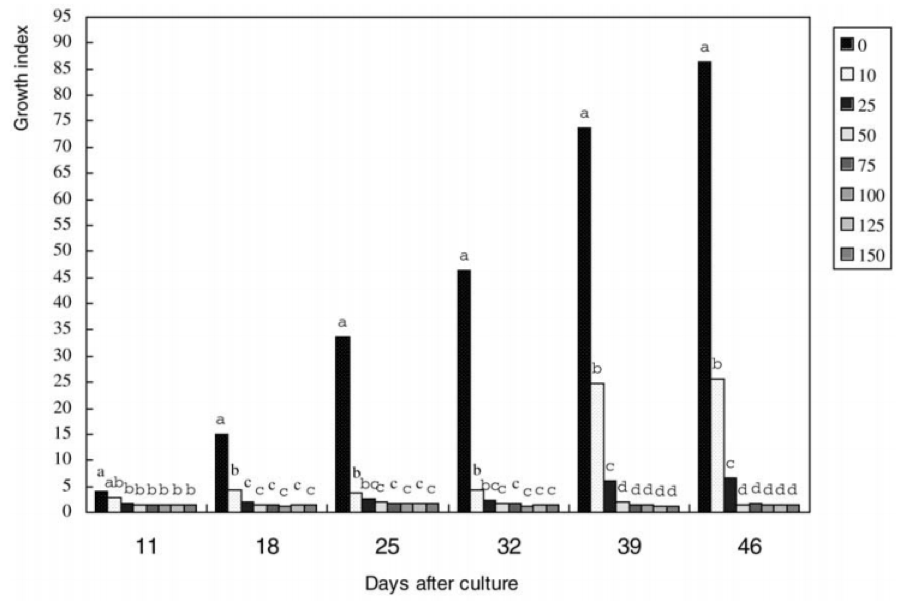
Hình 5. Chỉ số tăng trưởng của mô sẹo không phôi trong môi trường có 0, 10, 25, 50, 75, 100, 125 và 150 mg/L Km. Biểu đồ không được đánh dấu cùng một chữ cái khác biệt đáng kể ở mức 5%
Hình 6. Tỷ lệ gây ức chế của kanamycin đối với sự tăng trưởng của mô sẹo không phôi, với các nồng độ kanamycin 10, 25, 50, 75, 100, 125, 150 (mg/L)
Hình 7. Chỉ số tăng trưởng của mô sẹo phôi hóa ở môi trường bổ sung 0, 10, 25, 50, 75, 100, 125, 150 mg/L Km. Các biểu đồ của cùng một thời gian nuôi cấy không được đánh dấu cùng một chữ cái khác biệt đáng kể ở mức 5%
Hình 8. Tỷ lệ gây ức chế của kanamycin đối với sự tăng trưởng của mô sẹo không phôi, với các nồng độ kanamycin 10, 25, 50, 75, 100, 125, 150 (mg/L)
3.4 Ảnh hưởng của kanamycin đối với sự hình thành và phát triển của phôi somatic
Không có sự khác biệt đáng kể giữa kanamycin 10 mg/L và kiểm soát (không có kanamycin) trên tổng số phôi somatic ở mỗi gram mô sẹo tươi. Tuy nhiên, khi nồng độ kanamycin tăng lên trên 10 mg/L, tổng số phôi somatic giảm
(Hình 9). Điều này chỉ ra rằng nồng độ kanamycin cao sẽ ức chế sự hình thành phôi somatic của cây bông.
Ở nồng độ kanamycin thấp hơn (10 mg/L) một chút đã thúc đẩy sự biệt hóa phôi hình cầu (hình 9-11). Trên môi trường nuôi cấy bổ sung kanamycin 10 mg/L, có 192 phôi hình cầu trong 1 gram mô sẹo phôi hóa tươi; Nhưng chỉ có 175 phôi hình cầu được thu hoạch từ 1g mô sẹo phôi hóa trên môi trường không có kanamycin. Không có sự khác biệt đáng kể về tổng số phôi hình trái tim và phôi lá mầm giữa nồng độ kanamycin 10 mg/L và kiểm soát (không có kanamycin) (Hình 9).
Nồng độ Kanamycin trên 10 mg/L dẫn đến việc giảm tổng số phôi somatic, vì vậy chúng tôi kết luận rằng kanamycin ngăn chặn sự hình thành của phôi somatic. Mặt khác, kanamycin (trên 10 mg/L) ảnh hưởng đến hình thành phôi ở các giai đoạn phát triển khác nhau. Số lượng phôi hình cầu, phôi hình trái tim và phôi hình ngư lôi (trên 10 mg/L kanamycin) giảm khi nồng độ kanamycin tăng lên. Tuy nhiên, phôi lá mầm không bị ảnh hưởng bởi kanamycin ở nồng độ 10 đến 125 mg/L, thực sự được thúc đẩy biệt hóa bằng kanamycin ở 25 mg/L và chỉ bị ức chế một phần bởi kanamycin ở 150 mg/L. Những kết quả này chỉ ra rằng phôi somatic của cây bông trưởng thành (phôi lá mầm) không nhạy cảm với kanamycin. Do đó, rất khó để lựa chọn các biến đổi ở giai đoạn phát triển trưởng thành của phôi somatictic.
Kanamycin ảnh hưởng không chỉ đến sự hình thành và phát triển phôi somatic, mà còn là tỷ lệ phôi somatic ở các giai đoạn phát triển khác nhau (Hình 11). Việc bổ sung kanamycin làm giảm tỷ lệ phôi giai đoạn sớm (phôi hình cầu và phôi hình tim) từ 0.56% đến 10.54%, nhưng 10 mg/L kanamycin làm tăng tỷ lệ phôi hình cầu lên 5.23% (Hình 11). Việc bổ sung kanamycin làm tăng tỷ lệ phần trăm phôi hình ngư lôi và phôi lá mầm. Trên môi trường không có kanamycin, tỷ lệ phần trăm của phôi hình ngư lôi là 11.63. Tỷ lệ này tăng từ 15.09% đến 22.33% trên môi trường bổ sung từ 25 đến150 mg/L kanamycin, nhưng 10 mg/L kanamycin làm giảm tỷ lệ phần trăm phôi hình ngư lôi từ 11.63% xuống 6.27%. Tỷ lệ phôi lá mầm tăng lên trên tất cả các môi trường bổ sung kanamycin (Hình 11). Trên môi trường không có kanamycin, tỷ lệ phôi lá mầm chỉ là 3.99%, nhưng bổ sung kanamycin làm tăng tỷ lệ phần trăm phôi lá mầm từ 3.99% lên 4.95-10.04%. Kết quả cho thấy phôi giai đoạn sớm nhạy cảm với kanamycin hơn so với phôi trưởng thành.

Hình 9. Ảnh hưởng của kanamycin đối với sự hình thành và phát triển của phôi somatic (Số lượng trên 1 gram mô sẹo tươi). GE, HE, TE và CE tương ứng với các phôi hình cầu, hình trái tim, hình ngư lôi và phôi lá mầm
Hình 10. Sự ức chế của kanamycin lên sự hình thành và phát triển của phôi somatic. GE, HE, TE và CE tương ứng với các phôi hình cầu, hình trái tim, hình ngư lôi và phôi lá mầm
Hình 11. Ảnh hưởng của nồng độ kanamycin lên sự phát triển của phôi somatic. GE, HE, TE và CE tương ứng với các phôi hình cầu, hình trái tim, hình ngư lôi và phôi lá mầm
4. Thảo luận
Bông là cây trồng kinh tế quan trọng, được trồng ở 70 quốc gia trên thế giới. Hơn 180 triệu người có liên quan đến ngành công nghiệp sợi, vốn sản xuất bông thô khoảng 20 đến 30 tỷ đô la [19]. Công nghệ sinh học thực vật có tiềm năng to lớn trong việc cải thiện giống cây bông. Việc phát triển một hệ thống chuyển gen có hiệu quả trong cây bông phụ thuộc phần lớn vào sự sẵn có của các kỹ thuật nuôi cấy mô phù hợp, lựa chọn chính xác các biến đổi và thu hồi các cây chuyển gen. Các cây bông tái sinh lần đầu tiên thu được vào năm 1983 [8]. Kể từ đó, đã có những tiến bộ đáng kể. Các phôi somatic và cây tái sinh đã được thu thập từ các mẫu mô nuôi cấy khác nhau của một số loài bông ở nhiều phòng thí nghiệm [4, 25-27, 39, 41, 44, 51-53, 55]. Các quy trình tái tạo đã được sử dụng để có được các cây biến đổi gen sau khi chuyển gen gián tiếp Agrobacterium [1, 7, 12, 21, 24, 33, 40, 42, 43, 48] hoặc sau khi bắn phá hạt phần tử DNA [5, 11, 24, 28, 30, 34, 35]. Những cây chuyển gen kháng côn trùng và kháng thuốc diệt cỏ đã được sử dụng trong sản xuất bông [20, 50, 54]. Tuy nhiên, hiệu quả chuyển đổi thấp, đồng thời sự tồn tại của nhiều tế bào và thực vật biến đổi gen thoát ra đã hạn chế việc sử dụng rộng rãi và nhanh chóng công nghệ sinh học thực vật trong việc nhân giống và sản xuất cây bông[20, 54]. Hiệu quả cùa sự chọn lọc được cải thiện đối với những biến đổi của cây bông rất quan trọng cho sự phát triển của một hệ thống chuyển đổi gen thỏa đáng ở cây bông. Để đạt được điều này, chúng ta phải xem xét ba điểm sau đây.
4.1 Gen Npt II, kanamycin và biến đổi di truyền
Gen npt II, mã hóa phosphotransferase có khả năng phosphoryl hóa kháng sinh aminoglycosid bao gồm kanamycin, neomycin và geneticin [14], đã được phân lập từ plastid Tn 5 của vi khuẩn đột biến E. coli [2, 22, 29]. Trong số nhiều kháng sinh được sử dụng trong chuyển gen di truyền thực vật, kháng sinh được sử dụng phổ biến nhất là kanamycin [20, 38]. Các aminamoglycoside kanamycin liên kết với rRNA trong các tiểu đơn vị ribsome nhỏ của tế bào nhân sơ, gây ra mã hóa sai bộ ba mã sao và ức chế chuyển vị [9, 36], do đó hầu như tất cả các tế bào vi khuẩn và thực vật có độ nhạy cảm cao với kanamycin, và kanamycin được sử dụng như một tác nhân chọn lọc trong biến đổi thực vật. Gen npt II đã trở thành một gen marker chọn lọc quan trọng và được sử dụng rộng rãi trong quá trình biến đổi gen thực vật [13, 31] vì chọn lọc sức đề kháng có thể áp dụng cho các tế bào bị cô lập, mô sẹo, phôi somatic, các mô và các cây trồng [10, 14] . Các tế bào được biến đổi gen bằng gen npt II có thể giải trừ kháng sinh và vẫn còn sống, nhưng các tế bào không biến đổi sẽ chết vì chúng rất nhạy cảm với kháng sinh và thiếu phosphotransferase để giải độc các kháng sinh này.
Ti plastid, Agrobacterium, và các tế bào thực vật mang gen npt II có thể biểu hiện liên tục neomycin phosphotransferase. Chúng tôi đã nghiên cứu tác dụng của kanamycin đối với sự phát triển của Agrobacterium và cây bông chuyển gen mang gen npt II. Kết quả cho thấy kanamycin 0-200 mg/L không ảnh hưởng đến sự tăng trưởng và phát triển của Agrobacterium và cây bông chuyển gen ở mọi giai đoạn phát triển (dữ liệu không được hiển thị).
4.2. Kháng sinh, nuôi cấy mô tế bào và chuyển gen
Hai loại kháng sinh được sử dụng trong quá trình chuyển gen thực vật, đặc biệt là trong phương pháp chuyển gen gián tiếp Agrobacterium. Một là một tác nhân có thể lựa chọn (như kanamycin, hygromycin) được sử dụng để chọn các chất biến đổi, và một loại khác (như carbenicillin và cefotaxime) giết Agrobacterium.
Mặc dù có rất nhiều báo cáo về việc sản xuất cây biến đổi gen, nhưng ảnh hưởng của kháng sinh đối với nuôi cấy mô thực vật ít khi được điều tra. Thậm chí nếu có một số báo cáo, hầu hết trong số chúng tập trung chủ yếu vào carbenicillin và cefotaxime [3, 17, 18, 37, 46, 47]. Kanamycin là chất chọn lọc được sử dụng rộng rãi nhất trong quá trình chuyển đổi gen cây trồng, nhưng đến nay, chỉ có một vài báo cáo về tác dụng của kanamycin đối với nuôi cấy mô thực vật [6, 16].
4.3 Độ nhạy cảm của cây bông đối với kanamycin và xác định nồng độ kanamycin tối ưu đối với chuyển đổi gen ở cây bông
Điều rất quan trọng là phải xác định nồng độ phù hợp để chọn lọc các tế bào biến đổi gen. Nồng độ kháng sinh quá cao không chỉ giết chết những tế bào không biến đổi gen, mà còn ức chế tái tạo tế bào biến đổi gen [45]. Ngoài ra, nếu sử dụng kháng sinh quá thấp, hoặc nếu không cung cấp đủ kháng sinh, các tế bào không biến đổi gen có thể tăng lên và ức chế sự tăng trưởng và tái sinh tế bào biến đổi gen [23].
Mặc dù kanamycin được sử dụng rộng rãi trong quá trình biến đổi gen cây bông, nhưng nồng độ kanamycin chọn lọc tối ưu và hoạt tính của kanamycin ở các giai đoạn khác nhau của quá trình tái tạo cây bông chưa được báo cáo. Để xác định nồng độ của kanamycin có khả năng ức chế sự phát triển của quá trình nuôi cấy mô cây bông và hình thành phôi somatic, chúng tôi đã kiểm tra các nồng độ khác nhau và nồng độ tối ưu được mô tả trong phần kết quả (Hình 1-11 và Bảng 1).
Trong quá trình chuyển đổi gen cây bông trước đây, kanamycin 50 mg/L được sử dụng để chọn lọc các chất biến đổi ở mọi giai đoạn tái sinh. Kết quả của bài báo này chỉ ra rằng độ nhạy cảm của các mẫu mô, mô sẹo không phôi, mô sẹo phôi hóa và phôi somatic đối với kanamycin là khác nhau. Các mẫu mô và callus không phôi thì nhạy cảm hơn với kanamycin so với mô sẹo phôi hóa và phôi somatic. 10 mg/L kanamycin gây ức chế 90% sự tăng trưởng và tăng sinh mô sẹo và 50mg/L gây ức chế sự tăng trưởng hoàn toàn (Hình 6 và Bảng 1). 60 mg/L và 80 mg/L kanamycin ức chế hoàn toàn sự kích thích của mô sẹo từ mẫu mô lá mầm và hypocotyl (Hình 1-4 và Bảng 1). Ngược lại, mô sẹo phôi hóa và phôi somatic ít nhạy cảm với kanamycin (Bảng 1). Sự phát triển của mô sẹo phôi hóa không hoàn toàn bị ức chế, ngay cả ở môi trường bổ sung với kanamycin 150 mg/L (Hình 8 và Bảng 1), mà làm cho các mẫu mô biến thành màu trắng và chết đi và những mô sẹo không phôi hóa nâu và chết. Như vậy, sự lựa chọn nồng độ kanamycin nên thay đổi cùng với sự phát triển của quá trình nuôi cấy. Dựa trên các kết quả được mô tả trong thí nghiệm này, Bảng 1 khuyến cáo chọn nồng độ kanamycin và thời gian nuôi cấy phù hợp. Để so sánh với các phương pháp truyền thống, nồng độ cho sự chon lọc mẫu mô hypocotyl và mô sẹo phôi hóa được tăng lên từ 50 mg/L đến 60 và 200 mg/L kanamycin. Tuy nhiên, nồng độ cho sự chọn lọc của mẫu mô lá mầm và mô sẹo không phôi được giảm từ 50 mg/L xuống 40 và 25 mg/L kanamycin (Bảng 1). Cần điều chỉnh thời gian nuôi cấy cho các giai đoạn phát triển khác nhau (Bảng 1).
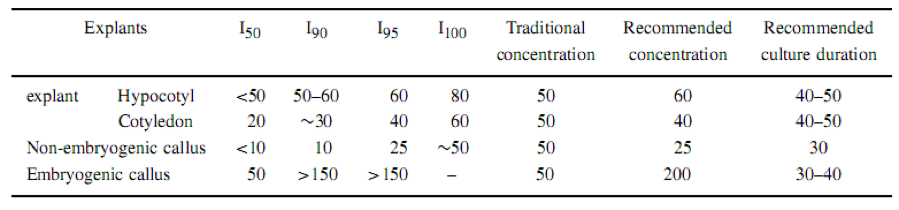
Bảng 1. Độ nhạy cảm của các mẫu mô khác nhau đối với kanamycin và nồng độ kanamycin đề nghị trong các giai đoạn biến đổi gen ở cây bông. I50, I90, I95 và I100 là nồng độ kanamycin gây 50%, 90%, 95% hoặc 100% sự ức chế kích thích hoặc tăng trưởng của mô sẹo sau 30-40 ngày nuôi cấy.
Nồng độ lựa chọn không phù hợp của kanamycin có thể là lý do chính cho tần suất biến đổi gen thấp và nhiều "sự thất thoát" (không biến đổi) trong quần thể cây tái sinh. Trong khi đó, ảnh hưởng việc ức chế của kanamycin đối với phôi somatic và tái sinh thực vật đòi hỏi việc sử dụng các sơ đồ thay thế để chọn lọc các tế bào biến đổi gen. Một khả năng để cải thiện khả năng chọn lọc là chọn lọc trước trong môi trường lỏng với nồng độ đề nghị của kanamycin. Chi tiết phương pháp là: sau khi nuôi cấy đồng thời trong 20-30 ngày, nuôi cấy được đưa vào môi trường lỏng với nồng độ kanamycin đề nghị trong 7-10 ngày, sau đó nuôi cấy trên môi trường không có kanamycin. Chúng tôi đã sử dụng phương pháp này và các nồng độ kanamycin đề xuất ở trên trong quá trình biến đổi gen ở cây bông với kết quả là tỷ lệ biến đổi gen đã tăng gấp đôi.
Lời cảm ơn
Các tác giả xin cảm ơn Drs Dwight Romanovicz và David Nobles của Đại học Texas tại Austin đã đọc bài viết này.
Tài liệu tham khảo
Bao-Hong Zhang*, Fang Liu, Zhi-Hong Liu, Hong-Mei Wang & Chang-Bing Yao
Key Laboratory of Cotton Genetic Improvement of the Ministry of Agriculture, Cotton Research Institute, Chinese Academy of Agricultural Sciences, Anyang Henan 455112, People’s Republic of China; e-mail: zbh68@hotmail.com (*author for correspondence, present address: Department of Agronomy and Horticulture, New Mexico State University, Las Cruces, NM 88003, USA)
Received 9 March 2000; accepted in revised form 25 October 2000
Key words: Gossypium hirsutum L., kanamycin, somatictic embryogenesis, tissue culture
1. Bayley C, Trolinder N, Ray C, Morgan M, Quisenberry JE and Ow DW (1992) Engineering 2,4-D resistance into cotton. Theoretical and Applied Genetics 83(5): 645 649
2. Beck E, Ludwig G, Auerswald EA, Reiss R and Schaller H (1982) Nucleotide sequence and exact localization of the neomycin phosphotransferase gene from transposon Tn5. Gene 19: 327–336
3. Chen ZM, Schnurr JA and Kapaun (1998) Timentin as an alter- native antibiotic for supression of Agrobacterium tumefaciens in genetic transformation. Plant Cell Reports 17: 646–649
4. Chen ZX, Li SJ and Trolider NL (1987) Some characteristics of somatic embryogenesis and plant regeneration in cotton cell suspension culture. Scientia Agricultura Sinica 20: 6–11
5. Chlan CA, Lin JM, Cary JW and Cleveland TE (1995) A procedure for biolistic transformation and regeneration of transgenic cotton from meristematic tissue. Plant Molecular Biology Reporter 13: 31–37
6. Colby SM and Meredith CP (1990) Kanamycin sensitivity of cultured tissue of Vitis. Plant Cell Reports 9: 237–240
7. Cousins YL, Lyon BR and Llewell DJ (1991) Transformation of an Australian cotton cultivar: prospects for cotton improve- ment through genetic engineering. Austalian Journal of Plant Physiology 18(5): 481–494
8. Davidonis GH and Hamilton RH (1983) Plant regeneration from callus tissue of Gossypium hirsutum L. Plant Science Letters 32: 89–93
9. Davies J, Gorini L and Davis BD (1965) Misreading of RNA codewords induced by aminoglycoside antibiotics. Mol Pharmacol 1: 93–106
10. DeBlock M, Herrera-Estrella L, Van Montagu M, Schell J and Zambryski P (1984) Expression of foreign gene in regenerated plants and their progeny. EMBO J 3: 1681 1689
11. Finer JJ and McMullen MD (1990) Transformation of cotton (Gossypium hirsutum L.) via particle bombardment. Plant Cell Reports 8: 586–589
12. Firoozabady E, DeBoer DL, Merlo DJ, Halls E, Halk EL, Amerson LN, Rashka KE and Murray EE (1987) Trans- formation of cotton (Gossypium hirsutum L.) by Agrobac- terium tumefaciens and regeneration of transgenic plants. Plant Molecular Biology 10: 105–106
13. Flavell RB, Dart E, Fuchs RL and Fraley RT (1992) Selectable marker genes: safer for plants? Bio/Technology 10: 141–144
14. Fraley RT, Roger SG and Horsch RB (1986) Genetic trans- formation in higher plants. Critical Reviews in Plant Science 4: 1–46
15. Gamborg O, Miller R and Ojima K (1968) Nutrient requirements of suspension cultures of soybean root cells. Experimental Cell Research 50: 151–158
16. Gimenez CA,MenendezYuffa A and deGarcia E (1996) Effect of the antibiotic kanamycin in different explants of Catimor, a hybrid coffee plant (Coffea species). Phyton-International Journal of Experimental Botany 59: 39–46
17. Holford P and Newbury HJ (1992) The effect of antibiotics and their breakdown products on the in vitro growth of Antirrhinum majus. Plant Cell Reports 11: 93–96
18. Humara JM and Ordas RJ (1999) The toxicity of antibiotics and herbicides on in vitro adventitious shoot formation on Pinus pinea L. cotyledons. In Vitro Cellular and Developmental Biology – Plant 35: 339–343
19. International Advisory Committee (1996) Cotton: Review of World Situation, Monogram by International Advisory Committee, Washington, DC
20. John ME (1997) Cotton crop improvement through genetic engineering. Critical Reviews in Biotechnology 17: 185–208
21. John ME and Crow LJ (1992) Gene expression in cotton (Gossypium hirsutum L.) fiber: cloning of the messenger RNAs. P. Natl Acad Sci USA 89(13): 5769–5773
22. Jorgensen RA, Rothstein SJ and Reznikoff WS (1979) A restriction enzyme cleavage map of Tn5 and location of a region encoding neomycin resistance. Molecular and General Genetics 177: 65–72
23. Kapaun JA and Cheng ZM (1999) Aminoglycoside antibiotics inhibit shoot regeneration from Siberian elm leaf explants. Hortsciences 34: 727–729
24. Keller G, Spatola L, McCabe D, Martinell B, Swain W and John ME (1997) Transgenic cotton resistant to herbicide bialaphos. Transgenic Research 6: 385–392
25. Kolganova TV, Srivastava DK and Mett VL (1992) Callusogenesis and regeneration of cotton (Gossypium hirsutum L. cv 108-F). Sov Plant Physiol 39: 232–236
26. Kumar S and Pental D (1998) Regeneration of Indian cotton variety MCU-5 through somatic embryogenesis. Current Science 74: 538–540
27. Luo JH and Gould JH (1999) In vitro shoot-tip grafting improves recovery of cotton plants from culture. Plant Cell Tissue and Organ Culture 57: 211–213
28. Lyon BR, Cousins YL, Llewell DJ and Dennis ES (1993) Cotton plants transformed with a bacterial degradation gene are protected from accidental spray drift damage by the herbicide 2,4-Dichlorophenoxyacetic acid. Transgenic Research 2(3): 162–169
29. Mazodier P, Cossart P, Giraud E and Gasser F (1985) Completion of the nucleotide sequence of the central region of Tn 5 confirms the presence of three resistance genes. Nucleic acids Research 13: 195–205
30. McCabe DE and Martinell BJ(1993) Transformation of elite cotton cultivars via particle bombardment of meristems. Biotechnology 11: 596–598
31. Moazed D and Noller HF (1987) Interaction of antibiotics with functional sites 16s ribosomal RNA. Nature 327: 389–394
32. Murashige T and Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 80: 662–668
33. Perlak FJ, Deaton RW, Armstrong TA, Fuchs RL, Sims SR, Greenplate JT and Fishhoff DA (1990) Insect resistant cotton plants. Bio/technology 8: 939–943
34. Rajasekaran K, Hudspeth RL, Cary JW, Anderson DM and Cleveland TE (2000) High-frequency stable transformation of cotton (Gossypium hirsutum L.) by particle bombardment of embryogenic cell suspension cultures. Plant Cell Reports 19: 539–545
35. Rajasekraran K, Grula JW, Hudspeth RL, Pofelis S and Anderson DM (1996) Herbicide-resistant Acala and Coker cotton transformed with a native gene encoding mutant forms of acetohydroxy acid syntheses. Molecular Breeding 2: 307–317
36. Recht MI, Douthwaite S and Puglisi JD (1999) Basis for prokaryotic specificity of action of aminoglycoside antibiotics. EMBO J 18: 3133–3138
37. Sarma KS, Evans NE and Selby C (1995) Effects of carbenicillin and cefotaxime on somatic embryogenesis of Sitka spruce (Picea sitchensis Carr). Journal of Experimental Botany 46: 1779–1781
38. Shaw CH, Leemans J, Shaw CH, Van Montagu M and Schell J (1983) A general method for the transfer of cloned genes to plant cells. Gene 23: 315–330
39. Shoemaker RC, Couche IJ and Galbraith DW (1986) Characterization of somatic embryogenesis and plant regeneration in cotton(Gossypium hirsutum L.). Plant Cell Reports 3: 178–181
40. Thomas JC, Adams DG, Keppenne VD,Wasmann CC, Brown JK, Kanost MR and Bohnert HJ (1995) Protease inhibitors of Manduce sexta expressed in transgenic cotton. Plant Cell Reports 14(12): 758–762
41. Trolider NL and Goodin JR (1986) Somatic embryogenesis and plant regeneration in cotton (Gossypium hirsutum L.). Plant Cell Reports 6: 231–234
42. Umbeck P, Swain W and Yang NS (1989) Inheritance and expression of genes for kanamycin and chloramphenicol. Crop Science 29(1): 196–201
43. Umbeck P, Tohnson G, Barton K and Swain W(1987) Genetically transformed cotton (Gossypium hirsutum L.) plant. Biotechnology 5: 263–266
44. Voo KS, Rugh CL and Kamalay JC (1991) Indirect somatic embryogenesis and plant recovery from cotton (Gossypium hirsutum L.). In Vitro Cell Dev Biol 27P: 117–124
45. Wilmink A and Dons JJM (1993) Selective agents and mark genes for use in transformation of monocotyledonous plant. Plant Molecular Biology Reports 11: 165–185
46. Yepes LM and Aldwinckle HS (1994) Factors that affect leaf regeneration efficiency in apple and effect of antibiotics in morphogenesis. Plant Cell Tissue and Organ Culture 37: 257–269
47. Yepes LM and Aldwinckle HS (1994) Micropropagation of 13 malus cultivars and rootstocks, and effect of antibiotics on proliferation. Plant Growth Regulation 15: 55–67
48. Zapata C, Park SH, Ei-Zik KM and Smith RH (1999) Transformation of a Texas cotton cultivar by using Agrobacterium and the shoot apex. Theoretical and Applied Genetics 98: 252–256
49. Zhang BH (1997) Cotton biotechnology and its application. Beijing: China Agricultural Press
50. Zhang BH and Feng R (1998) Achievement, problems and strategies of transgenic insect-resistant cotton. Acta Agronomica Sinica 24: 238–246
51. Zhang BH, Feng R, Li XL and Li FL (1996) Anther culture and plant regeneration of cotton (Gossypium klotzschianum Anderss). Chinese Science Bulletin 41: 145–148
52. Zhang BH, Feng R, Liu F and Yao CB (1999) Direct induction of cotton somatic embryogenesis. Chinese Science Bulletin 44: 766–767
53. Zhang BH, Liu F and Yao CB (2000) Plant regeneration via somatic embryogenesis in cotton. Plant Cell, Tissue and Organ Culture 60: 89–94
54. Zhang BH, Liu F, Yao CB and Wang KB (2000) Recent progress in cotton biotechnology and genetic engineering in China. Current Science 79: 37–44
55. Zhang DL and Wang ZZ (1989) Tissue culture and embryogenesis of Gossypium hirsutum L. Acta Botanica Sinica 31: 161–163
Minh Hiếu
SBC Scientific
Hotline: 0945677929
Email: info@sbc-vietnam.com